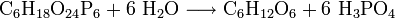- Inositol
-
Strukturformel 
myo-Inosit
Allgemeines Name Inosit Andere Namen - Cyclohexanhexol
- Inositol
Summenformel C6H12O6 CAS-Nummer 87-89-8 ATC-Code Kurzbeschreibung weißer, kristalliner, geruchloser Feststoff [1] mit süßlichem Geschmack
Eigenschaften Molare Masse 180,16 g·mol−1 Aggregatzustand fest
Dichte 1,75 g·cm−3 [1]
Schmelzpunkt Löslichkeit gut löslich in Wasser: 250 g·l−1 (20 °C) [2]
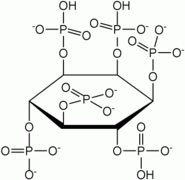
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Inosit (der Inosit; auch, vor allem im Engl.: Inositol; veraltet: „Muskelzucker“) ist der Trivialname für Cyclohexanhexol, einen sechswertigen cyclischen Alkohol. Abhängig von der Stellung der Hydroxylgruppen sind theoretisch neun Stereoisomere möglich, wobei es ein Enantiomerenpaar gibt (chiro-Inosit). Bei der häufigsten Form stehen die Hydroxylgruppen an den Kohlenstoffatomen 1, 2, 3 und 5 auf derselben Seite des Rings und die Hydroxylgruppen an C4 und C6 auf der gegenüberliegenden Seite. Diese Form trägt den systematischen Namen Cyclohexan-cis-1,2,3,5-trans-4,6-hexol und den Trivialnamen myo-Inosit und kommt in vielen tierischen und pflanzlichen Geweben vor.
Die Trivialnamen der anderen Isomere sind: scyllo-, D-chiro-, L-chiro-, muco-, neo-, allo-, epi- und cis-Inosit. Diese Formen treten jedoch nur sehr selten auf.
Alle Isomere haben einen süßlichen Geschmack.
Entgegen dem Namen Muskelzucker handelt es sich bei Inosit nicht um ein Kohlenhydrat, da er keine Carbonylgruppe besitzt und daher auch kein cyclisches Halbacetal bilden kann. Er erfüllt lediglich das ursprüngliche Kriterium eines "Kohlen-Hydrats" (hydratisierter Kohlenstoff), nämlich dass dessen Summenformel Cn(H2O)n ist bzw. dass Inosit ein Isomer (dieselbe Summenformel) zu Glucose und Fructose ist.
Die eigentlich aus dem angloamerikanischen Sprachraum stammende Variante Inositol hat sich in den Naturwissenschaften eingebürgert, vor allem in zusammengesetzten Begriffen ist sie die weitaus gebräuchlichere Variante.
Inhaltsverzeichnis
Vorkommen und Bedeutung
Im Körper tritt Inosit zumeist mit Phosphaten verestert auf. Er wurde früher den B-Vitaminen zugeordnet, jedoch ist der Vitamincharakter heute umstritten. Bei Mikroorganismen wirkt Inosit als Wachstumsfaktor und wird dort als Bios I bezeichnet. In nahezu allen höheren Pflanzen tritt er als Komponente von Sphingolipiden auf. In Pilzen, Bakterien und Teilen höherer Pflanzen kommt der Alkohol vorwiegend als Phytinsäure (Inositolhexaphosphorsäure) vor.[3]
Second Messenger
Das 1D-myo-Inositol-1,4,5-trisphosphat (vereinfacht Inositoltrisphosphat, IP3) spielt als second messenger bei der Signalübertragung in Zellen eine wichtige Rolle. Es wird dabei durch Phospholipase-vermittelte hydrolytische Spaltung des Phospholipids Phosphatidylinositol-4,5-bisphosphat (PIP2) – in Diacylglycerin (DAG) und eben IP3 – freigesetzt. IP3 ist in der Lage, den Zellstoffwechsel zu beeinflussen, so bewirkt es beispielsweise den Anstieg der Ca2+-Konzentration innerhalb der Zelle.
Siehe auch:
- Signalwege des Insulins
- Inositol-1,4,5-triphosphat (IP3) als Second Messenger
- Funktion der Phospholipase C, Signaltransduktion bei der Proteinkinase C
- Endoplasmatisches Retikulum als Calcium-Speicher
Gewinnung
myo-Inosit wird durch Hydrolyse von Phytinsäure gewonnen, die wiederum aus Maisquellwasser isolierbar ist:
Verwendung
Inosit ist im Handel als Nahrungsergänzungsmittel für Menschen oder Pferde erhältlich. Aufgrund seiner optischen Ähnlichkeit, der leichten Verfügbarkeit und des geringen Preises wird Inositpulver oft zum Strecken von Kokain oder N-Methylamphetamin verwendet. [4]
Quellen
- ↑ a b c d Herstellerangaben der Firma Alfa Aesar zu myo-Inosit, 6. Mai. 2007
- ↑ Herstellerangaben der Firma Merck zu myo-Inosit, 6. Mai. 2007
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Inositole im Lexikon der Chemie, abgerufen 04. Juni 2008
- ↑ National Drug Intelligence Center: South Carolina Drug Threat Assessment : Methamphetamine, Dezember 2001
Wikimedia Foundation.