- Ammoniumcarbamat
-
Strukturformel 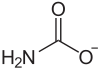
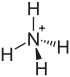
Allgemeines Name Ammoniumcarbamat Andere Namen keine
Summenformel CH6N2O2 CAS-Nummer 1111-78-0 Kurzbeschreibung weißer Feststoff mit ammoniakartigem Geruch[1]
Eigenschaften Molare Masse 78,07 g·mol−1 Aggregatzustand fest
Dichte 1,6 g·cm−3[1]
Schmelzpunkt Siedepunkt Zersetzung ab 35 °C[1]
Dampfdruck Löslichkeit gut in Wasser (790 g·l−1 bei 20 °C)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 
Achtung
H- und P-Sätze H: 302 EUH: keine EUH-Sätze P: keine P-Sätze [2] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36 S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ammoniumcarbamat ist das Ammoniumsalz der Carbaminsäure, die in freiem Zustand nicht bekannt ist. Es ist ein Nebenbestandteil von Hirschhornsalz.
Inhaltsverzeichnis
Eigenschaften
Ammoniumcarbamat bildet ein farbloses Kristallpulver, das sich in Wasser gut (zu 790 g/l) löst. Durch Zugabe von Ammoniakgas wird die Löslichkeit noch erhöht. In wässriger Lösung hydrolysiert Ammoniumcarbamat ab 35 °C teilweise, oberhalb von 60 °C vollständig unter Bildung von Ammoniumcarbonat, das wiederum in Ammoniak und Kohlenstoffdioxid zerfallen kann. Beim Erhitzen in einem geschlossenen System wandelt sich das Salz bei Temperaturen oberhalb von 130 °C allmählich in Harnstoff um. Die Umwandlungsgeschwindigkeit nimmt mit steigender Temperatur stark zu, wobei das gebildete Wasser katalytisch wirkt.
Synthese
Ammoniumcarbamat entsteht durch direkte Reaktion von Ammoniakgas und CO2 im Volumenverhältnis 2:1 unter Ausschluss von Wasser.
Verwendung
Ammoniumcarbamat wird in der Kosmetikindustrie und bei der Herstellung von Schädlingsbekämpfungsmitteln verwendet. Es ist auch eine wichtige Zwischenstufe bei der Herstellung von Harnstoff. Weitere Verwendung findet es als Reinigungs-, Beiz- und Neutralisationsmittel, sowie in dem oben erwähntem Hirschhornsalz zum Backen. In Deutschland beträgt die Direktproduktion von Ammoniumcarbamat wegen der geringen Nachfrage lediglich rund 1000 t/a.
Einzelnachweise
Wikimedia Foundation.
