- Carbamid
-
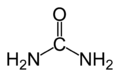
Strukturformel 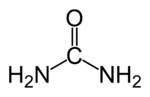
Allgemeines Name Harnstoff Andere Namen - Kohlensäurediamid
- Carbamid
- Carbonyldiamid
- Diamid der Kohlensäure
- Urea (lat.)
- Piagran (granulierter Harnstoff)
Summenformel CH4N2O CAS-Nummer 57-13-6 PubChem 1176 ATC-Code Kurzbeschreibung farb- und geruchloser, kristalliner Feststoff[1] Eigenschaften Molare Masse 60,06 g·mol−1 Aggregatzustand fest
Dichte 1,3230 g·cm−3 [2]
Schmelzpunkt 132,5–134,5 °C (Zersetzung) [2]
Dampfdruck pKs-Wert Löslichkeit leicht löslich in Wasser: ca. 1000 g·l−1 (20 °C)[2], löslich in Ethanol: 50 g·l−1 (20 °C), schwer löslich in Ether und Chloroform
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 WGK 1 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Harnstoff (lat. Urea), chemisch Kohlensäurediamid, ist eine organische Verbindung, die von vielen Tieren als ein Endprodukt des Stoffwechsels von Stickstoffverbindungen (z. B. Aminosäuren) im sogenannten Harnstoffzyklus produziert und im Urin ausgeschieden wird. Reiner Harnstoff ist ein weißer, kristalliner, ungiftiger und hygienisch unbedenklicher Feststoff, der nicht mit Harnsäure zu verwechseln ist.
Inhaltsverzeichnis
Geschichte
Harnstoff gilt als die erste, aus anorganischen Ausgangsstoffen synthetisch hergestellte organische Verbindung. Sie wurde 1773 von Hilaire Rouelle als Substanz entdeckt und 1828 von Friedrich Wöhler erstmals durch Reaktion von Kaliumcyanat und Ammoniumsulfat künstlich synthetisiert.
Das widersprach der damals verbreiteten Vorstellung, dass organische Substanzen grundsätzlich nur von Lebewesen durch die so genannte „vis vitalis“ (Lebenskraft) hergestellt werden könnten. Genau genommen hat F. Wöhler bereits 1824 durch Hydrolyse von Dicyan zu Oxalsäure den Nachweis erbracht, dass es für die Synthese organischer Moleküle nicht der „Lebenskraft“ bedarf.[6]
Physiologische Bedeutung
Harnstoff wird im Protein- und Aminosäure-Stoffwechsel gebildet und gehört zu den harnpflichtigen Substanzen. Bei Säugetieren, Schildkröten, einigen Fischen und bei adulten Amphibien stellt er die wichtigste Ausscheidungsform des insbesondere in Proteinen enthaltenen Stickstoffs dar. Vögel und die meisten Reptilien bilden stattdessen Harnsäure; Kaulquappen, die meisten Fischearten und die anderen Wassertiere scheiden den Stickstoff als Ammoniak aus.
Um beim Aminosäureabbau die Entstehung von giftigem Ammoniak (NH3) aus den Aminogruppen zu vermeiden, werden diese in der Leber im Zuge des Harnstoffzyklus auf das ungiftige Harnstoffmolekül übertragen. Dieser wird als Stoffwechselendprodukt über die Nieren ausgeschieden.
Erkrankungen, wie das akute oder chronische Nierenversagen, sowie eine diabetisch eingeschränkte Nierenfunktion, können zu erhöhten Harnstoffwerten im Serum/Plasma führen.
Störungen und Besonderheiten
Eine hohe Proteinzufuhr führt auch schon bei normaler Nierenfunktion zu erhöhten Harnstoffwerten, was ihn zu einem schlechten Nierenparameter macht.
Anwendungen
Aufgrund seines hohen Stickstoffgehaltes von 46 % ist Harnstoff weltweit das bedeutendste Stickstoffdüngemittel. Harnstoff wird wegen seiner hohen Wasserbindungsfähigkeit darüber hinaus häufig als Feuchtigkeitsfaktor in Kosmetika eingesetzt. In der Pharmazie kennt man Harnstoff als Keratolytikum. Diese Eigenschaft macht man sich in verschiedenen Rezepturen zunutze. Beispielsweise wirkt es hoch konzentriert (40 %) in Pasten zusammen mit einem Antipilzmittel (Antimykotikum) gegen Nagelpilz (Onychomykose), wobei der Harnstoff den Nagel so weich macht, dass sich die infizierte Nagelsubstanz Stück für Stück abtragen lässt. Weiter dient es als Feuchtigkeitsspender in Salben zur Bekämpfung von atopischen Ekzemen und Lichenerkrankungen.
Zigarettenhersteller mischen Harnstoff dem Tabak bei, damit das Nikotin durch Erhöhung des pH-Wertes in der Lunge besser aufgenommen werden kann. So werden aus vermeintlich leichten Zigaretten, auf deren Packung ein niedriger Nikotinwert angegeben ist, starke Zigaretten.
Harnstoff kann auch als Streusalz-Ersatz eingesetzt werden; aus Kostengründen ist dies aber nicht rentabel.
Harnstoff wird zur Reduktion von Stickoxiden im Abgas von Kraftwerken und Verbrennungsmotoren verwendet. In Kraftwerken wird – vornehmlich bei kleineren Anlagen das SNCR- Verfahren (selektive nicht-katalytische Reduktion) angewandt. Beim sogenannten SCR-Verfahren (Selektive katalytische Reduktion), das in Kraftwerken und in zunehmendem Maß auch in der Fahrzeugtechnik eingesetzt wird, wird Harnstoff oder Ammoniak in den heißen Abgasstrom eingespritzt. Der Harnstoff zersetzt sich zu Ammoniak, das in einem nachgeschalteten Katalysator die Stickoxide reduziert. In der Kraftfahrzeugtechnik wird eine wässrige Lösung mit 32,5 % Harnstoffanteil verwendet, die unter dem Handelsnamen AdBlue bekannt ist. Der Verbrauch an Harnstofflösung beträgt etwa 2 bis 8 % des Treibstoffverbrauchs.
Harnstoff wird Lebensmitteln als Stabilisator zugesetzt. In der EU ist er als Lebensmittelzusatzstoff mit der Bezeichnung E 927b ausschließlich für Kaugummi ohne Zuckerzusatz zugelassen.
Eigenschaften
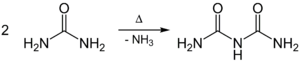
Harnstoff kondensiert beim Erhitzen über den Schmelzpunkt unter Abspaltung von Ammoniak (NH3) zu Biuret:
Industrielle Herstellung
Harnstoff wird in großen Mengen industriell hergestellt (2004: 127 Mio t weltweit) und dient z. B. als Stickstoffdünger oder als NOx-Reduktionsmittel beim SNCR-Verfahren. In Ländern mit großen Erdgasvorkommen, die früher oft einfach abgefackelt wurden, wird Erdgas heute in Harnstoff umgewandelt. Dazu dienen große Anlagen, die aus Erdgas, Luft und Wasser in den Prozessschritten Wasserstoffherstellung → Ammoniakherstellung → Harnstoffsynthese, schließlich Harnstoff herstellen. (Streng genommen werden die genannten Edukte in ein Prozessgas bestehend aus H2, N2 und CO2 umgesetzt, aus dem das CO2 entfernt wird. Wasserstoff und Stickstoff werden dann in Ammoniak umgewandelt. Reiner Wasserstoff kommt in dieser Kette nicht vor). Das für die Ammoniakherstellung abgetrennte CO2 wird später im Harnstoff gebunden und nicht in die Atmosphäre freigesetzt. Der zunächst in Lösung anfallende Harnstoff wird in Granulat umgewandelt und in Säcken oder auch lose vertrieben. Die größten Anlagen der Welt produzieren ca. 4.000 t Harnstoff am Tag.
Reaktionsgleichungen:
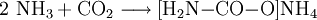
- Ammoniak und Kohlenstoffdioxid reagieren zu Ammoniumcarbamat.
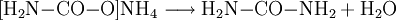
- Ammoniumcarbamat reagiert zu Harnstoff und Wasser.
Eine industrielle Weiterverwendung von Harnstoff ist die Herstellung von Melamin, das z. B. mit Formaldehyd zu Kunstharzen verarbeitet wird, und von Harnstoff-Formaldehyd-Harzen (Harnstoffharz, so genannte UF-Harze), die z. B. zur Produktion von Spanplatten eingesetzt werden.
Einzelnachweise
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006
- ↑ a b c d e Eintrag zu Harnstoff in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 23.07.2007 (JavaScript erforderlich)
- ↑ Bordwell pKa-Table
- ↑ pKa Data Compiled by R. Williams
- ↑ Harnstoff bei ChemIDplus
- ↑ Burckhard Frank: 250 Jahre Chemie in Göttingen. In: Hans-Heinrich Voigt (Hrsg.): Naturwissenschaften in Göttingen. Eine Vortragsreihe. Vandenhoeck + Ruprecht Gm, Göttingen 1988, ISBN 3525358431 (Göttinger Universitätsschriften. Band 13), S. 72 ([1]und[2])
Siehe auch
Wikimedia Foundation.