- Kristallviolett
-
Strukturformel 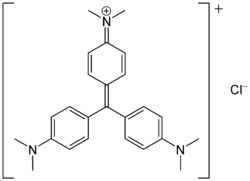
Allgemeines Name Kristallviolett Andere Namen - Hexamethylen-p-rosanilinchlorid
- Hexamethyl-p-rosaniliniumchlorid
- Gentianaviolett
- Methylviolett 10B
- Methylrosanilium
- Methylrosaniliumchlorid
- Methylrosanilin
- blaues Pyoktanin
- C.I. Basic Violet 3
- C.I. 42555
- (4-(4,4′-Bis(dimethylaminophenyl) benzhydryliden)cyclohexa-2,5-dien-1- yliden)dimethylammoniumchlorid
Summenformel C25H30ClN3 CAS-Nummer 548-62-9 PubChem 11057 Kurzbeschreibung grüner, geruchloser Feststoff [1]
Eigenschaften Molare Masse 407,99 g·mol−1 Aggregatzustand fest
Dichte 1,19 g·cm−3 [1]
Schmelzpunkt Löslichkeit 10 g·l−1 in Wasser bei 20 °C [1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 



Gefahr
H- und P-Sätze H: 350-302-318-410 EUH: keine EUH-Sätze P: 273-280-305+351+338-308+313 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 22-40-41-50/53 S: (2)-26-36/37/39-46-60-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kristallviolett (nach dem botanischen Namen des Enzians auch Gentianaviolett genannt) ist ein violetter Triphenylmethanfarbstoff.
Inhaltsverzeichnis
Darstellung
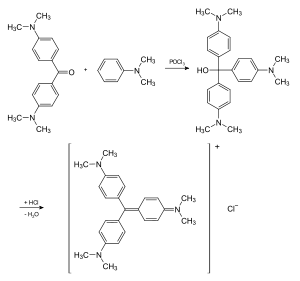
Kristallviolett wird durch die Kondensation von Michlers Keton (4,4′-Bis-dimethylamino-benzophenon) mit N,N-Dimethylanilin in Gegenwart von Phosphorylchlorid erhalten. Dabei findet eine elektrophile Substitution an N,N-Dimethylanilin in para-Stellung durch den Kohlenstoff der Carbonylgruppe von Michlers Keton statt. Das Phosphorylchlorid dient als Elektronenpaarakzeptor für den Sauerstoff der Carbonylgruppe des Ketons. Das Kohlenstoffatom ist dadurch positiv geladen und damit in der Lage, den Aromaten elektrophil anzugreifen. Aus der entstehenden Carbinolbase wird anschließend Wasser eliminiert.
Eigenschaften
Kristallviolett liegt meist in Form feiner, metallisch-gold glänzender Nadeln vor. Es löst sich in Wasser und anderen polaren Lösungsmitteln mit intensiv violetter Farbe und färbt Naturfasern leuchtend violett. Es ist jedoch verhältnismäßig leicht auswaschbar. Mit Iod bildet es einen Charge-Transfer-Komplex.
Gibt man zu einer stark verdünnten Kristallviolettlösung Natronlauge, so entfärbt sich die Lösung langsam. Hierbei lagert sich ein Hydroxidion an das in einer mesomeren Grenzform im Zentrum des Moleküls gebildete Carbeniumion. Diese Reaktion lässt sich reaktionskinetisch mit einem Photometer (siehe Photometrie) untersuchen. Bei einem großen Konzentrationsunterschied (Konzentration Kristallviolett viel kleiner als die Konzentration von Natronlauge) läuft eine Reaktion 1. Ordnung ab (siehe Kinetik (Chemie)).[3]
Verwendung
Kristallviolett findet Verwendung als Farbstoff in Farbbändern, als Kristallviolettlacton in Durchschreibpapieren[4] oder in Kopierstiften und vor allem in der mikroskopischen Färbetechnik. Hier bildet es den Hauptbestandteil der sogenannten Gram-Färbung, mit deren Hilfe sich Bakterien grob klassifizieren lassen.
Kristallviolett wird als pH-Indikator bei der wasserfreien Gehaltsbestimmung von schwachen Basen eingesetzt. Säuert man eine Lösung von Kristallviolett leicht an, erfolgt ein Farbumschlag von Violett nach Grün, weil das Auxochrom des dritten Kernes seine elektronenliefernde Fähigkeit und damit seine Farbrelevanz durch Addition eines Protons verliert. Ein stärkeres Ansäuern führt zu einer gelben Verbindung, bei der ein weiteres Auxochrom durch Protonierung deaktiviert wird.
Medizinisch wurde Kristallviolett lange Zeit, bis zur Entdeckung anderer wirksamer Antimykotika, zur Behandlung von Hautpilzerkrankungen (Mykosen), insbesondere Fußpilzen, sowie von Mundsoor verwendet. Dazu wird es als sogenannte Pyoktaninlösung (1–2%) aufgepinselt. Heute wird es wegen der lästigen Einfärbung der Haut in der westlichen Welt fast nur noch in der Naturheilkunde verwendet. Nach Empfehlungen der WHO ist Kristallviolett jedoch als ein essenzielles Medikament einzustufen[5].
Intravenös wird es eingesetzt zur Therapie von sekundären Lungenmykosen. Die fungistatische Wirkung von Kristallviolett ist, je nach Mykosenart, um den Faktor 10–100 stärker als das heute stark verbreitete Clotrimazol. Übertroffen wird es nur noch von Amphotericin B, welches jedoch im Vergleich stark toxisch ist. Daher wird Kristallviolett häufig bei immungeschwächten Patienten eingesetzt.
Kristallviolett darf nicht ins Auge gelangen, da es schwere Augenschäden verursachen kann. Ferner ist bei äußerlicher Anwendung eine Überdosierung zu vermeiden, da Kristallviolett, ebenso wie die verwandten und ähnlich verwendeten Triphenylmethanfarbstoffe Malachitgrün und Brillantgrün, zelltoxisch auf die Haut wirkt.
Literatur
- Gemeinhardt: Endomykosen. VEB Verlag der Wissenschaften, 1973
- Braun, Guenther, Schubert: Dermatologie – Lehrbuch für Studenten. VEB Verlag für Volk und Gesundheit, 1986
Einzelnachweise
- ↑ a b c d e Eintrag zu Kristallviolett in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Juli 2008 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 548-62-9 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Jansen/Ralle/Peper: Reaktionskinetik und chemisches Gleichgewicht, Aulis Verlag Köln 1984, S. 49, S.206, ISBN 3-7614-0642-8
- ↑ Hobein/Lutz: Mikroverkapselung, Praxis Schriftenreihe Chemie Band 49, Aulis Verlag Köln 1989, S.43, ISBN 3-7614-1200-2
- ↑ WHO Model Lists of Essential Medicines, März 2007 (englisch)
Weblinks
Kategorien:- Krebserzeugender Stoff
- Gesundheitsschädlicher Stoff
- Umweltgefährlicher Stoff
- Stoff mit Verdacht auf krebserzeugende Wirkung
- Antimykotikum
- Triphenylmethanfarbstoff
- Aminobenzol
- Quartäre Ammoniumverbindung
- Chlorid
- Cyclohexadien
- Alken
Wikimedia Foundation.