- Ethylgrün
-
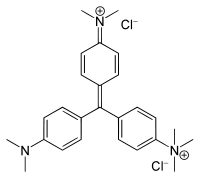
Strukturformel 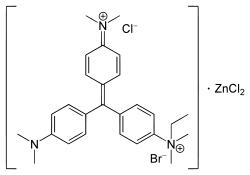
Allgemeines Name Ethylgrün Andere Namen - C.I. 42590
- Methylgrün (irrtümlicherweise)
- 4-((4-(Dimethylamino)phenyl)(4-(dimethyliminio) cyclohexa-2,5-dien-1-ylidene)methyl)- N-ethyl-N,N-dimethylanilinium-bromid-chlorid (Zinkchlorid)
Summenformel C27H35BrClN3·ZnCl2 CAS-Nummer 7114-03-6 PubChem 3084002 Kurzbeschreibung dunkelrotbrauner, kristalliner Feststoff[1]
Eigenschaften Molare Masse 653,26 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit 70 g·l−1 in Wasser (20 °C), 1 g·l−1 in Ethanol, nicht in Xylol[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 


Gefahr
H- und P-Sätze H: 314-351-411 EUH: keine EUH-Sätze P: 273-280-301+330+331-305+351+338 [1] EU-Gefahrstoffkennzeichnung [1] 

Ätzend Umwelt-
gefährlich(C) (N) R- und S-Sätze R: 34-51/53 S: 26-36/37/39-45-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ethylgrün ist ein grüner Triphenylmethanfarbstoff. Ethylgrün wird häufig auch als Methylgrün bezeichnet und verkauft.
Inhaltsverzeichnis
Methylgrün und Terminologie
Ethylgrün (C.I. 42590) wird häufig als Methylgrün[3] (C.I. 42585, CAS-Nr. 82-94-0) bezeichnet, obwohl letzteres wahrscheinlich seit Jahren nicht mehr hergestellt wird.[4][5] Bei Merck Index und Sigma-Aldrich wird das verwandte Methylgrün indes als Ethylgrün aufgeführt.
Methylgrün hat statt einer Ethylgruppe eine Methylgruppe am Stickstoffatom; diese Methylgruppe kann leicht dissoziieren, so dass daraus Kristallviolett entsteht. Physikalisch unterscheiden sich die beiden Farbstoffe kaum, so dass die Verwendung von Methylgrün keine Auswirkungen hat.
Synthese
Durch Ethylierung von Kristallviolett mit Ethylbromid und folgendem Aussalzen in Natriumchlorid wird Ethylgrün hergestellt. Daher liegt Ethylgrün meistens als gemischtes Bromid-Chlorid vor. Es ist aber unwahrscheinlich, dass die Stöchiometrie von Cl− zu Br− genau 1:1 beträgt. Normalerweise wird Ethylgrün als Zinksalz verkauft.
Eigenschaften
Ethylgrün bildet ein grünes, in Wasser lösliches Pulver. Es ähnelt stark dem Farbstoff Kristallviolett. Ethylgrün ist etwas stabiler als Methylgrün, da dessen Methylgruppe leicht dissoziieren kann.
Im pH-Bereich von 0,8 bis 1,8 liegt der Umschlagspunkt Ethylgrüns von gelb nach blau.
Verwendung
Ethylgrün als Farbstoff tritt häufig in Verwendung. So wird es unter anderem in der Mikroskopie als Kern- und Mitochondrienfarbstoff eingesetzt. Dabei wird Ethylgrün wegen seiner bläulich-grünen Farbe auch als Gegenfarbstoff bei Färbungen in der Histologie, bei Immunofärbungen und in-situ-Hybridisierung genutzt.[6][7]
Ethylgrün dient darüber hinaus zur Farbdifferenzierung zwischen Diphtherie und anderen Bakterien. In Verbindung mit Pyronin Y findet es überdies bei der Differenzierung zwischen DNA und RNA Verwendung (Unna-Pappenheim-Färbung).[8] Zu diesem Zweck darf die Farbstoffmischung kein Kristallviolett enthalten, welches man aber mit einer Chloroformausschüttelung vom Methylgrün isolieren kann.
Vereinzelt wurde Ethylgrün auch zur Lebendfärbung von Wimpertierchen eingesetzt.[9] Daneben kommt es bei der Konfokalmikroskop zum Einsatz, um doppelsträngige DNA in Hautzellen detektieren zu können.[10]
Schließlich wurde Ethylgrün auch in der Forensik verwendet.[11]
Einzelnachweise
- ↑ a b c d e Datenblatt Methylgrün Zinkchlorid Doppelsalz (C.I. 42590) bei Merck, abgerufen am 31. März 2011.
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ Andere Namen für Methylgrün:
- C.I. Basic Blue 20
- Parisgrün
- Heptamethyl-p-rosanilinchlorid
- Doppelgrün SF
- Double Green SF
- Hoffmann’s Grün
- Grünpulver
- Vert Lumiére
- Vert de Paris
- Vert Etincelle
- ↑ Floyd J. Green (1990): Sigma-Aldrich Handbook of Stains, Dyes, and Indicators. Aldrich Chemical Company, Milwaukee, Wisconsin. ISBN 0-941633-22-5, S. 458.
- ↑ Harald Conn und Ralph D. Lillie (Hrsg.) (1977): Biological Stains. Lippincott Williams and Wilkins; 9. Auflage: ISBN 0-683-05034-6; S. 280.
- ↑ Marilyn Gamble und John D. Bancroft (2002): Theory and Practice of Histological Techniques. Churchill Livingstone; 5. Auflage; ISBN 0-443-06435-0.
- ↑ Clark, G. (1981): Staining procedures used by the Biological Stain Commission. 4. Auflage, Williams and Wilkins; Baltimore.
- ↑ P.G. Unna, Monatshefte für praktische Dermatologie, 1902, Bd. 55, S. 76.
- ↑ Foissner, W.: Basic light and scanning electron microscope methods for taxonomic studies of ciliated protozoa. In: Europ J Protistol (1991) 27, S. 313–330.
- ↑ Ito, Y. und Otsuki, Y.: Localization of apoptotic cells in the human epidermis by an in situ DNA nick end-labeling method using confocal reflectant laser microscopy. In: J Histochem Cytochem. (1998) 46(6), S. 783–786; PMID 9603792; PDF (freier Volltextzugriff)
- ↑ Kempton, JB. und Rowe, WF.: Contrast Enhancement of Cyanoacrylate-Developed Latent Fingerprints Using Biological Stains and Commercial Fabric Dyes. In: Journal of Forensic Sciences (1992) 37(1), S. 95–105.
Literatur
- Horobin, RW. und Kiernan, JA. (2002): Conn's Biological Stains: A Handbook of Dyes, Stains and Fluorochromes for Use in Biology and Medicine. BIOS Scientific Publ., 10. Auflage; ISBN 1-85996-099-5; S. 196 und 197.
Weblinks
Kategorien:- Stoff mit Verdacht auf krebserzeugende Wirkung
- Ätzender Stoff
- Umweltgefährlicher Stoff
- Triphenylmethanfarbstoff
Wikimedia Foundation.