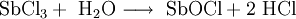- Antimonbutter
-
Kristallstruktur 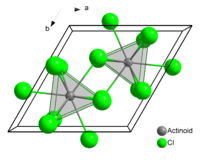
Allgemeines Name Antimon(III)-chlorid Andere Namen - Antimontrichlorid
- Spießglanzbutter
- Antimonbutter
Verhältnisformel SbCl3 CAS-Nummer 10025-91-9 Kurzbeschreibung farblose, hygroskopische, weiche Masse mit stechendem Geruch Eigenschaften Molare Masse 228,11 g/mol Aggregatzustand fest
Dichte 3,14 g/cm³[1]
Schmelzpunkt 73 °C[1]
Siedepunkt 223 °C[1]
Dampfdruck 0,16 mbar bei 20 °C[1]
Löslichkeit - leicht löslich in Wasser (931 g/l bei 20 °C[1])
- löslich in Ethanol Chloroform, Benzol, Aceton, Schwefelkohlenstoff, Dioxan, Tetrachlorkohlenstoff und Ether
- unlöslich in Pyridin, Chinolin und organischen Basen
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Ätzend Umwelt-
gefährlich(C) (N) R- und S-Sätze R: 34-51/53 S: (1/2)-26-45-61 LD50 525 - 675 mg/kg oral Ratte[3]
WGK 2[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Antimon(III)-chlorid ist eine chemische Verbindung bestehend aus den Elementen Antimon und Chlor Es gehört zur Stoffklasse der Chloride.
Inhaltsverzeichnis
Geschichte
Antimon(III)-chlorid wurde zuerst von Johann Rudolph Glauber dargestellt.
Gewinnung und Darstellung
Antimon(III)-chlorid kann durch Reaktion von Antimon oder Antimon(III)-oxid mit konzentrierter Salzsäure gewonnen werden.
Eigenschaften
Physikalische Eigenschaften
Antimon(III)-chlorid kristallisiert in einer verzerrten Uran(III)-chlorid-Struktur. Sie liegt in Form einer weichen Masse mit stechendem Geruch vor, welche an feuchter Luft raucht. Die Dämpfe von Antimon(III)-chlorid sind 7,88 mal schwerer als Luft.
Chemische Eigenschaften
Antimon(III)-chlorid ist leicht löslich in Wasser, hydrolysiert jedoch heftig bei Zugabe größerer Mengen Wasser, wobei Antimonoxychlorid und Chlorwasserstoff entstehen.
Verwendung
Antimon(III)-chlorid wird als Reagenz zum Nachweis von Vitamin A und anderen Carotinoiden beim Carr-Price-Test verwendet, wobei eine blaue Komplexverbindung entsteht, die durch Colormetrie gemessen werden kann. Es dient weiterhin als Katalysator für Polymerisations- und Chlorierungsreaktionen in der organischen Chemie, bei der Herstellung von Flammschutzmitteln, Pigmenten und anderen Antimonverbindungen. Weiterhin wurde die Verbindung früher Absinth zugesetzt, um künstlich eine milchige Trübung des Getränks hervorzurufen.
Sicherheitshinweise
Antimon(III)-chlorid ist als krebserzeugend nach Kategorie 2 und keimzellmutagen nach Kategorie 3B eingestuft.
Quellen
- ↑ a b c d e f Eintrag zu CAS-Nr. 10025-91-9 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 23.10.2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 10025-91-9 im European chemical Substances Information System ESIS
- ↑ Datenblatt von BgChemie
Wikimedia Foundation.