- Lugolsche Lösung
-
Allgemeines Name Iod-Kaliumiodid-Lösung Andere Namen Lugol'sche Lösung
Summenformel nicht zutreffend CAS-Nummer 7553-56-2 Kurzbeschreibung braune Flüssigkeit Eigenschaften Molare Masse nicht zutreffend Aggregatzustand flüssig
Dichte 1,122 g/cm3[1]
Dampfdruck 23 hPa (bei 20°C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 20/21-50 S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Iod-Kaliumiodid-Lösung (oder im Laborjargon Iod-Iodkalium) ist eine Lösung von Iod in Wasser. Elementares Iod ist in Wasser kaum löslich. Liegen jedoch schon gelöste Iodid-Ionen vor, löst sich das Iod unter Bildung von Polyiodidionen:
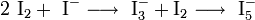
Daher wird Kaliumiodid zugegeben.
Iod ist sehr viel besser in Ethanol löslich, aber manchmal ist Ethanol als Lösungsmittel unerwünscht, weil es entflammbar ist und schnell verdunstet sowie zu unerwünschten Nebenreaktionen führen kann. Ist Iod in Alkohol gelöst, bezeichnet man die Lösung als Iodtinktur.
Inhaltsverzeichnis
Anwendungsbereiche
Eine Iod-Kaliumiodid-Lösung wird für verschiedene Zwecke in der analytischen Chemie und in der Medizin verwendet. Beispiele:
- zur Gramfärbung in der Mikrobiologie,
- zum Chitinnachweis in der Mikroskopie oder in der Lebensmittelchemie,
- zum Nachweis von Stärke, meist mit der lugolschen Lösung,
- als Desinfektionsmittel,
- als Maßlösung in der Iodometrie,
- Pathologen verwenden die Lösung, um bei der Autopsie eine Amyloidose (z. B. bei Alzheimer) nachzuweisen,
- Einsatz für das das sogenannte Plummern bei Schilddrüsenüberfunktion,
- zur Fixierung und Konservierung von Phytoplankton-Proben.
Lugolsche Lösung
Die Lugolsche Lösung ist eine Iod-Kaliumiodid-Lösung mit einem Verhältnis von 1:2 von Iod zu Kaliumiodid in Wasser, die auch im Handel angeboten wird. Sie ist nach dem französischen Arzt Jean Guillaume Lugol (1786–1851) benannt, der sie 1835 entdeckte.[2]
Mechanismus des Stärkenachweises
Der Stärkenachweis beruht auf einer charakteristischen und sehr empfindlichen Farbreaktion. Die I5−-Ionen können sich in die Stärke-Moleküle einlagern. Die Einschlussverbindung hat bei Amylose eine blaue und bei Amylopektin eine rotviolette Farbe. Der Unterschied beruht darauf, dass die Amylose-Moleküle schraubenförmig gedreht sind, wodurch sich die Lichtabsorption verändert.
Quellen
- ↑ a b c Sicherheitsdatenblatt Carl Roth GmbH + Co.KG
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.3. Georg Thieme Verlag KG, Stuttgart 2008.
Wikimedia Foundation.
