- Alzheimer-Krankheit
-
Vergleichende Klassifikation nach DSM-IV ICD-10 G30.-+ Alzheimer-Krankheit G30.1 Alzheimer-Krankheit mit spätem Beginn (nach 65. Lj.) 290.10-290.13 Demenz vom Alzheimer Typ F00.-* Demenz bei Alzheimer-Krankheit 290.0; 290.3; 290.20; 290.21 Demenz vom Alzheimer Typ, mit spätem Beginn F00.1* Demenz bei Alzheimer-Krankheit, mit spätem Beginn (Typ 1), auch Senile Demenz vom Alzheimer-Typ (SDAT) DSM IV online ICD-10 online Die Alzheimer-Krankheit (AK) (lateinisch Morbus Alzheimer) ist eine neurodegenerative Erkrankung, die in ihrer häufigsten Form bei Personen über dem 65. Lebensjahr auftritt und für ungefähr 60 Prozent der weltweit etwa 24 Millionen Demenzerkrankungen verantwortlich zeichnet.[1]
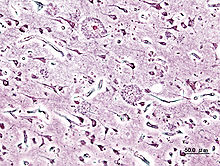
Charakteristisch ist eine zunehmende Verschlechterung der kognitiven Leistungsfähigkeit, die in der Regel mit einer Abnahme der täglichen Aktivitäten, mit Verhaltensauffälligkeiten und neuropsychologischen Symptomen einhergeht. Bereits viele Jahre bevor erste klinische Symptome sichtbar werden, bilden sich im Gehirn des Betroffenen Plaques, die aus fehlerhaft gefalteten Beta-Amyloid-(Aβ-)Peptiden bestehen. Zusammen mit den Plaques sind Neurofibrillen, die sich in Form von Knäueln in den Neuronen ablagern, kennzeichnend (pathognomonisch) für die Erkrankung. Morbus Alzheimer gehört zu den Tauopathien, da sich bei dieser neurodegenerativen Erkrankung fehlerhafte Tau-Proteine aus dem Zellkörper heraus an die Axome anlagern und nicht mehr zurück in den Zellkörpern können und die Zellen bis zur Unfähigkeit hin einschränken.
Die zugrunde liegenden Veränderungen sind noch nicht behandelbar.
Bis heute ist die Ursache der Alzheimer-Erkrankung nicht vollständig geklärt. Auf genetischer Ebene wurde eine Variante im Gen für das ApoE identifiziert, die einen Risikofaktor für die Entwicklung einer Alzheimer-Erkrankung darstellt. Darüber hinaus wurden kausale Mutationen in drei verschiedenen Genen gefunden (Präsenilin-1 und -2 und Amyloid-Precursor-Protein (APP, Amyloid-Vorläuferprotein), die als Auslöser der seltenen früh auftretenden Unterform gelten. Die Veränderungen in allen vier Genen führen dazu, dass sich früher als bei der nichterblichen-sporadischen Form große Mengen von Beta-Amyloid im Gehirn anhäufen. Ihr Anteil an der Entstehung von Alzheimer (population attributable risk) wird auf maximal 30 % geschätzt.
Geschichte
Im Jahr 1901 beschrieb der deutsche Psychiater und Neuropathologe Alois Alzheimer den ersten Fall der Krankheit, welche später als Alzheimer-Krankheit bekannt wurde. Die Patientin war eine 50 Jahre alte Frau namens Auguste Deter. Alois Alzheimer begleitete die Frau nach der Aufnahme in die Frankfurter Nervenklinik. Auguste D. blieb in der Klinik bis zu ihrem Tode im Jahr 1906. Alois Alzheimer war zu dieser Zeit schon Laborleiter bei Emil Kraepelin in München. Er war an dem Fall interessiert, ließ sich das Gehirn der verstorbenen Patientin von Emil Sioli schicken und veröffentlichte erst danach seine Ergebnisse.[2][3][4]
In den folgenden fünf Jahren wurden elf ähnliche Fälle in der medizinischen Literatur beschrieben; einige bereits unter Verwendung der Bezeichnung »Alzheimer-Krankheit«.[5]
Die offizielle Benennung geht auf den Psychiater Emil Kraepelin zurück. Er benannte die Erkrankung in der achten Ausgabe seines Lehrbuch der Psychiatrie aus dem Jahre 1910 nach Alois Alzheimer.[6]
Da die von Alois Alzheimer betreute Patientin mit 50 Jahren relativ jung war, beschrieb er die Erkrankung als präsenile Demenz. Erst später erkannte man, dass dieselben histologischen Veränderungen auch bei älteren Demenz-Patienten auftreten. Zur Abgrenzung gegenüber dem 'echten' (präsenilen) Morbus Alzheimer bezeichnet man die Erkrankungsform des älteren Menschen als Senile Demenz vom Alzheimer-Typ (SDAT oder DVAT). Im Jahr 1997 wurden originale Mikroskop-Präparate von Alois Alzheimers Arbeit in München wiederentdeckt und neu evaluiert.[7]
Häufigkeit
Von Alzheimer sind fast ausschließlich Menschen höheren Alters betroffen. Durch die Bevölkerungsentwicklung in den westlichen Industrienationen mit immer älter werdenden Bürgern steigt daher auch die Alzheimer-Prävalenz. Unter den 65-Jährigen sind etwa zwei Prozent betroffen, bei den 70-Jährigen sind es bereits drei Prozent, unter den 75-Jährigen sechs Prozent und bei den 85-Jährigen zeigen etwa 20 % Symptome der Krankheit. Über dem 85. Lebensjahr nimmt der Anteil der Betroffenen wieder ab, da die zuvor Erkrankten nur selten dieses Lebensalter erreichen. Der jüngste bisher bekannte Alzheimer-Patient erkrankte mit 27 Jahren und starb mit 33.[8]
In Deutschland leiden aktuell mehr als 1,3 Millionen Menschen unter einer Demenzerkrankung, bis 2050 wird ein Anstieg auf 2,6 Millionen prognostiziert.[9] 700.000 der aktuell Betroffenen leiden unter Morbus Alzheimer. Jedes Jahr werden etwa 250.000 neue Demenzerkrankungen diagnostiziert, von denen etwa 120.000 vom Alzheimertyp sind.[10]
Im Jahr 2007 waren weltweit etwa 29 Millionen Menschen von der Alzheimer-Krankheit betroffen. Nach Auswertung von Computermodellen soll sich diese Zahl, die auf Bevölkerungsprognosen der Vereinten Nationen basieren, bis zum Jahr 2050 auf rund 106 Millionen Patienten erhöhen; im Durchschnitt kommt dann auf 85 Menschen ein Alzheimer-Patient.[11][12]
Vererbung
Es gibt eine genetische Komponente in der Verursachung der Alzheimer-Krankheit. Etwa fünf bis zehn Prozent der Betroffenen zeigen eine familiäre Häufung [Familial Alzheimer Disease (FAD)], die auf Mutationen des Präsenilin-1-Gens auf Chromosom 14, des Präsenilin-2-Gens auf Chromosom 1 oder des APP-Gens auf Chromosom 21 zurückzuführen sind. Zusätzlich konnte eine noch unklare Verbindung zwischen der Alzheimerschen Erkrankung und dem ε4-Allel von Apolipoprotein E (ApoE), einem am Cholesterin-Transport beteiligten Protein, hergestellt werden.
Das Down-Syndrom mit seiner dreifachen Anlage von Erbmaterial des Chromosoms 21, auf dem sich das APP-Gen befindet, erhöht ebenfalls das Risiko, an einer Demenz, evtl. der Alzheimer-Krankheit, zu erkranken, wobei der Nachweis bei Menschen mit dieser Genommutation durch eine meist vorliegende kognitive Beeinträchtigung erschwert wird.
Weiterhin ist eine Mutationsvariante des SORL1-Gens als erhöhter Risikofaktor für diese Erkrankung genannt worden.[13]
Krankheitsverlauf innerhalb des Körpers
Im Gehirn von Alzheimer-Patienten bilden sich senile Plaques und fibrilläre Ablagerungen. Die Proteinablagerungen der Plaques bestehen im Wesentlichen aus dem Beta-Amyloid-Peptid. Die intrazellulär gelegenen Neurofibrillenbündel bestehen aus dem Tau-Protein. Dieses aggregiert zu Fibrillen, wenn es stärker als normal phosphoryliert, d. h. mit Phosphorsäureresten besetzt ist („Hyperphosphorylierung“). Es ist ungeklärt, ob diese Tau-Phosphorylierung sekundärer Natur oder krankheitsauslösend ist.
Im Krankheitsverlauf nimmt die Hirnmasse durch das Absterben von Neuronen vermehrt ab; man spricht dabei von einer Hirnatrophie. Außerdem wird der Botenstoff Acetylcholin nicht mehr in ausreichenden Mengen produziert (unter anderem durch Verminderung des im Nucleus basalis Meynert vorkommenden Enzyms Cholinacetyltransferase, das die Zusammensetzung von Acetyl-CoA und Cholin katalysiert), was zu einer allgemeinen Leistungsschwächung des Gehirns führt.
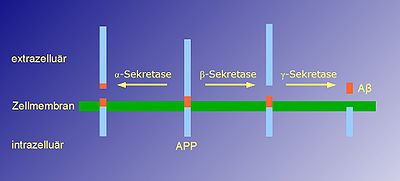
Das Beta-Amyloid-Peptid entsteht aus einem Vorläuferprotein, dem Amyloid-Precursor-Protein (APP), bei dem es sich um ein integrales Membranprotein handelt. Der größte Anteil dieses Proteins ragt aus der Zelle heraus (befindet sich extrazellulär siehe Extrazelluläre Matrix), während sich nur ein kleiner Anteil innerhalb der Zelle befindet (intrazellulär). Es handelt sich um ein Typ I-Transmembranprotein: Sein Amino-Terminus befindet sich auf der Zellaußenseite, während sein Carboxyl-Terminus innerhalb der Zelle zu finden ist.
APP wird von proteinspaltenden Enzymen, den sogenannten Sekretasen (Alpha-Sekretasen, Beta-Sekretase und Gamma-Sekretase) gespalten, wodurch es zur Freisetzung des Beta-Amyloid-Peptids aus dem Vorläuferprotein kommen kann. Grundsätzlich gibt es zwei Wege, wie APP gespalten werden kann.
- Der nicht-amyloidogene Weg: APP wird durch eine α-Sekretase geschnitten. Dieser Schnitt findet innerhalb des Teils von APP statt, der Beta-Amyloid enthält. Dadurch wird die Bildung von Beta-Amyloid verhindert. Es kommt zur Freisetzung eines großen extrazellulären Anteils, dessen Funktion nicht endgültig geklärt ist.
- Der amyloidogene Weg: APP wird zuerst von der β-Sekretase geschnitten und nachfolgend von der γ-Sekretase. Dieser Schnitt, der innerhalb der Transmembrandomäne erfolgt, führt zur Freisetzung von Beta-Amyloid.
Beide Vorgänge können parallel in Nervenzellen stattfinden. Die durch β- und γ-Sekretase gebildeten Beta-Amyloid-Peptide variieren in ihrer Länge. Der Haupttyp Beta-Amyloid-40 ist 40, während ein kleiner Anteil, Beta-Amyloid-42, 42 Aminosäuren lang ist. Die Länge des Beta-Amyloids ist von zentraler pathologischer Bedeutung, da das längere Beta-Amyloid-42 eine wesentlich höhere Tendenz zur Aggregation aufweist als das kleinere Beta-Amyloid-40.
Kandidaten für die α-Sekretase sind die Proteasen ADAM 10, ADAM17/TACE und für die β-Sekretase BACE1. Die γ-Sekretase besteht aus einem hochmolekularen Komplex aus den Proteinen Präsenilin 1 bzw. 2, PEN-2, APH-1 und Nicastrin, wobei nicht geklärt ist, ob nicht noch weitere Proteine daran beteiligt sind.
Bei der Alzheimer-Erkrankung ist die Funktion der Mitochondrien gestört. Eine Blockade der Atmungskette am Komplex IV führt zu einer übermäßigen Produktion von Radikalen, die die Zelle schädigen. Ob diese Blockade eine Konsequenz der übermäßigen Beta-Amyloid-Produktion ist oder ob Beta-Amyloid als Antioxidans gegen diesen neu entstandenen oxidativen Stress übermäßig produziert wird, ist bis heute offen.
Neue Erkenntnisse
Die Nonnenstudie von David Snowdon zeigt eine starke Abweichung des pathologischen Gehirn-Befunds (multiple Alzheimer-Plaques) und der wiederholt erhobenen psychischen Leistungsfähigkeit zu Lebzeiten. Pat McGeer vermutet entzündliche Prozesse im Gehirn als Ursache der Erkrankung. Thomas Bayer sieht die ursächlichen Prozesse in den Nervenzellen.
Beta-Amyloid-Proteine zeigen in vitro eine starke antimikrobielle Wirkung. Eine Vermutung ist, dass sie als Defensivantwort bei einer noch unbekannten Infektion entstehen.[14]
Forschung an zukünftigen Impfstoffen
An einer Impfung, die der Krankheit vorbeugen oder zumindest das Fortschreiten der Krankheit verhindern können soll, wird vielfach geforscht.[15]
So wird eine Beta-Amyloid-Immuntherapie auf Basis des monoklonalen Antikörpers Bapineuzumab bereits in klinischen Studien untersucht.[16]
Eine Göttinger Forschergruppe wies nach, dass eine Impfung mit dem neuen monoklonalen Antikörper (9D5) bei Mäusen das Fortschreiten der Krankheit verhindert. Dieser Antikörper richtet sich gegen eine bestimmte Molekülstruktur im Gehirn und hindert sie daran, das Eiweiß Pyroglutamat-Abeta zu produzieren. Dieses Eiweiß bildet giftige Verklumpungen (Oligomere), die sich in den Nervenzellen und Blutgefäßen des Gehirns von Alzheimer-Erkrankten ansammeln und so die krankheitsauslösenden Schädigungen hervorrufen. Eine Anwendung beim Menschen ist Gegenstand weiterer Untersuchungen.[17][18]
Erkennen der Krankheit durch typisches Verhalten der erkrankten Menschen
Erste Warnzeichen
Das amerikanische National Institute on Aging[19] hat sieben Warnzeichen formuliert, die auf eine beginnende Alzheimersche Krankheit hinweisen können und welche die Menschen in der nahen Umgebung veranlassen sollten, ärztlichen Rat einzuholen:
- Der Erkrankte wiederholt immer wieder die gleiche Frage.
- Der Erkrankte erzählt immer wieder die gleiche kurze Geschichte.
- Der Erkrankte weiß nicht mehr, wie bestimmte alltägliche Verrichtungen wie Kochen, Kartenspiel, Handhabung der TV-Fernbedienung funktionieren.
- Der Erkrankte hat den sicheren Umgang mit Geld, Überweisungen, Rechnungen und Ähnlichem verloren.
- Der Erkrankte findet viele Gegenstände nicht mehr oder er legt sie an ungewöhnliche Plätze (unabsichtliches Verstecken) und verdächtigt andere Personen, den vermissten Gegenstand weggenommen zu haben.
- Der Erkrankte vernachlässigt anhaltend sein Äußeres, bestreitet dies aber.
- Der Erkrankte antwortet auf Fragen, indem er die ihm gestellte Frage wiederholt.
Der Verlauf wird in verschiedene Stadien unterteilt, in denen jeweils andere physische und psychische Einschränkungen im Vordergrund stehen.
Prä-Demenz-Stadium
Bereits acht Jahre bevor Alzheimer sicher diagnostiziert werden kann, sind geringe Auffälligkeiten in neuropsychologischen Tests nachweisbar.[20][21][22] Probleme mit dem Kurzzeitgedächtnis und damit in Verbindung stehende Probleme, neue Information aufzufassen, sind dabei am leichtesten zu erkennen. Unter Umständen kommt es bereits zu leichten Beeinträchtigungen beim Sprachverständnis und der persönlichen Zieleverfolgung. Beeinträchtigungen des Affekts wie Depression und Teilnahmslosigkeit sind üblich.
Früh- und Mittelstadium
Bei den meisten Patienten führen die Defizite beim Lernen und der Gedächtnisleistung zur Diagnosestellung.[23] Während das Langzeitgedächtnis, gewohnte Tätigkeitsabläufe und emotionale Erlebnisse meist noch gut gegenwärtig sind, sind das Lernen und das Kurzzeitgedächtnis am stärksten eingeschränkt.[24][25] Das Sprachvermögen der Betroffenen ist insgesamt reduziert, was sich im Sprachfluss und durch ein vermindertes Vokabular äußert. Grundsätzlich sind sie aber in der Lage, ihre Gedanken und Ideen anderen Personen in geeigneter Weise mitzuteilen.[26][27][28] Die Feinmotorik zeigt bereits gewisse Unsicherheiten, die bei Tätigkeiten wie Schreiben, Malen oder Ankleiden erkennbar sind.[29] Beim Übergang der Erkrankung zum Mittelstadium sind einige Patienten noch in der Lage, selbstständig ihren Alltag zu gestalten, bei komplizierten oder komplexen Tätigkeiten sind sie jedoch bereits auf Unterstützung angewiesen.[23]
Fortgeschrittene Demenz
Im fortgeschrittenen Stadium verlernen die Patienten altbekannte Fertigkeiten und erkennen nahestehende Personen und alltägliche Gegenstände nicht mehr wieder.[30][31] Auch bei Patienten, die vor der Erkrankung ein friedfertiges Wesen besessen haben, kann es für Außenstehende zu scheinbar unbegründeten Wut- und Gewaltausbrüchen kommen. Schuldgefühle und allgemein eine innere Selbstreflexion nehmen im weiteren Verlauf immer mehr ab, so wie viele menschliche Verhaltensmuster nur noch automatisiert abzulaufen scheinen.
Die Muskulatur baut kontinuierlich ab, was zu weiteren Sprachproblemen, Harn- bzw. Stuhlinkontinenz und einer immer weiter abnehmenden Mobilität bis hin zur Bettlägerigkeit führt. Ein typisches Symptom sind Trippelschritte. Ohne Unterstützung können die Betroffenen ihren Alltag nicht mehr meistern und brauchen auch bei einfachen Tätigkeiten Unterstützung. Die Krankheit schreitet bis zum Tode voran, der bei derart geschwächten Patienten oft durch eine Lungenentzündung oder einen Herzinfarkt ausgelöst wird.
Prognose
Nachdem die Diagnose Alzheimer gestellt worden ist, beträgt die verbleibende Lebenserwartung in etwa sieben bis zehn Jahre, wobei es auch Fälle gibt, in denen das Endstadium bereits nach vier bis fünf Jahren erreicht ist. Auf der anderen Seite gab es Patienten, die noch über 20 Jahre gelebt haben.
Erkennen der Krankheit durch wissenschaftliche Methoden
Vom „National Institute on Aging“ und der US-Alzheimer-Gesellschaft wurden im April 2011 neue Empfehlungen zu Diagnose der Alzheimer Krankheit veröffentlicht.[32] Diese überarbeiteten Diagnose-Kriterien werden aber als noch ungeeignet für den allgemeinen klinischen Alltag angesehen und sollten daher spezialisierten Zentren vorbehalten sein.[33] In den aktualisierten Leitlinien werden drei ineinander übergehende Stadien unterschieden:
- Das präklinische Stadium des Morbus Alzheimer,[34]
- das Stadium der leichten kognitiven Beeinträchtigung („Mild Cognitive Impairment“, MCI)[35] und
- das Stadium der Demenz als Folge der Alzheimer Erkrankung.[36]
Eine relativ sichere in vivo-Diagnose ist bislang nur in den Stadien Demenz und MCI möglich - und zwar durch eine Kombination von anamnestischen Befunden, neuropsychologischen Tests, laborchemischen (Liquor-Biomarker) und bildgebenden Befunden.[37] Dies gilt für das MCI Stadium jedoch nur sehr eingeschränkt, da die hier erforderlichen bildgebenden Verfahren, vor allem die direkte Amyloid-Darstellung mittels Positronenemissionstomographie (PET und radioaktiven Tracern wie Florbetaben)[38] sowie die unterschiedlichen funktionellen Magnetresonanztomographie-Verfahren (fMRT) zwar als viel versprechend gelten, aber für den klinischen Alltag in der Regel noch als zu aufwendig und zu teuer.[39] Viele Fragen zur Interpretation der Befunde sind außerdem noch nicht beantwortet. Die Messung von Biomarkern (Beta-Amyloid, Gesamt-Tau-Protein, phosphoryliertes Tau, Amyloid-Vorläufer-Proteine) im Liquor setzt eine Lumbalpunktion, also ein invasives Verfahren voraus. Einen standardisierten, alltagstauglichen Bluttest gibt es nicht.[35]
Im klinischen Alltag ergibt sich die Verdachtsdiagnose auf einen Morbus Alzheimer durch spezielle Tests zur Beurteilung des Gedächtnisses, durch die sogenannte Fremdanamnese, den klinischen Verlauf und allgemein verfügbare bildgebende Verfahren wie Computertomographie oder Magnetresonanztomographie. Definitiv bestätigt werden kann die Diagnose jedoch erst nach dem Tod des Patienten, indem eine feingewebliche Untersuchung des Gehirns durchgeführt wird.[40]
Der Diagnoseschlüssel ICD-10 unterscheidet zwischen G30.- Alzheimer-Krankheit und G30.1 Alzheimer-Krankheit mit spätem Beginn allein nach dem Alter beim Auftreten erkennbarer Symptome.
Die Alzheimer-Krankheit muss stets von anderen, ähnlichen psychischen und neurologischen Störungen abgegrenzt werden, etwa von
- Normaler altersbedingter Vergesslichkeit
- Verweigerung oder Vermeidungsverhalten
- Leichter kognitiver Störung des Alters (unter der Chiffre ICD-10 F06.7 Organische psychische Störungen eingeordnet)
- Depression bei älteren Menschen mit Denkhemmung (evtl. mit zusätzlichen kognitiven Störungen im Sinne einer Zweiterkrankung)
- Deprivationserscheinungen bzw. Hospitalismus und Regression in Altersheimen
- Einfacher Aphasie
- Einfachem Mutismus
- Schwerem Autismus (Kanner-Syndrom) mit Mutismus
- Schweren neurologischen Syndromen wie dem Apallischen Syndrom, dem Locked-in-Syndrom oder dem akinetischen Mutismus
- Gehirntumoren, Gehirnverletzungen, die zu einem organischen amnestischen Syndrom führten. (ICD-10 F04)
- Störungen des Stoffwechsels (beispielsweise Unterzuckerung bei Diabetikern)
- Schlaganfall
- Normaldruckhydrozephalus
- Delirium
- Psychosen und Wahn (beispielsweise Schizophrenie, Manie oder psychotische Depression)
- anderen Formen von Demenz
- Sprachstörungen, Wortfindungsstörungen und totaler Verlust der Sprache.
Verhinderung der Krankheit
Verschiedene vorbeugende Maßnahmen gegen typische Zivilisationskrankheiten scheinen auch die Wahrscheinlichkeit zu senken, an Alzheimer zu erkranken. Die Datenlage und wissenschaftliche Akzeptanz von verschiedenen Nahrungsergänzungsmitteln, Verhaltensrichtlinien, Ernährungsvorschlägen, Umwelteinflüssen und Ersterkrankungen als Auslöser der Krankheit ist unterschiedlich.[41] Dabei ist wichtig, dass Maßnahmen, die in der Lage sind, das Auftreten der Erkrankung zu verhindern, nicht unbedingt geeignet sind, den Verlauf einer bereits diagnostizierten Alzheimer-Krankheit günstig zu beeinflussen. Es gibt viele beobachtende Studien, jedoch nur wenige kontrolliert-randomisierte, welche die Wirksamkeit der Maßnahmen belegen. Bis heute (2006) wurde nach diesen strengen Studienkriterien nur für die Kontrolle des Blutdrucks eine signifikante Senkung des Alzheimer-Risikos festgestellt. Genauso fehlen bis heute aber auch nachweislich vorbeugende Arzneimittel.[42]
Ausreichende Bewegung, gesunde Ernährung mit einem hohen Anteil sekundärer Pflanzenstoffe wie dem Antioxidans Quercetin,[43] ungesättigter Fettsäuren,[44] B-Vitamine[45] – insbesondere Folsäure[46][47][48][49] sowie der Verzicht auf Nikotin[50] können sich positiv auswirken. Die Vitamine Folsäure, B6 und B12 bauen die toxische Aminosäure Homocystein zu ungefährlichen Substanzen ab. Wissenschaftliche Studien belegen, dass Homocystein ein entscheidender Mitauslöser der Arteriosklerose ist und das Gehirn verstärkt altern lässt: Menschen mit hohen Homocystein-Werten in der Lebensmitte haben ein doppelt so hohes Risiko an Alzheimer zu erkranken.[51] Außerdem geht ein niedriger Vitamin-B12-Spiegel mit einer größeren Hirnatrophierate einher. Die Atrophierate des Gehirns von Patienten mit leichter kognitiver Beeinträchtigung lässt sich allerdings durch eine Behandlung mit Folsäure, Vitamin B12 und B6 um 29,6 Prozent senken.[52] Ein hohes Ausbildungsniveau[53] scheint ebenso günstig zu sein wie geistig anspruchsvolle Tätigkeiten.[54][55] Häufiger Fernsehkonsum steht dagegen im Verdacht, das Alzheimer-Risiko zu erhöhen.[56] Bluthochdruck[57] sollte möglichst früh erkannt und gut behandelt werden, um das Risiko einer Demenz zu senken. Wissenschaftliche Untersuchungen (Beyreuther et al.) haben ergeben, dass ein erhöhter Cholesterinspiegel das Risiko, an Alzheimer zu erkranken, erhöht.[58]
Als Risikofaktoren gelten – neben dem unvermeidbaren Altern und genetischer Disposition – ein vorangegangenes Schädel-Hirn-Trauma[59], Stoffwechselerkrankungen - Insulinresistenz und Hyperinsulinämie[60][61][62], Diabetes[63] und hohe Cholesterin-Werte[64] sowie Erkrankungen des kardiovaskulären Systems – Bluthochdruck[65] und erlittene Schlaganfälle.[66]
In einer Studie aus dem Jahre 2000 wurde ein möglicher Zusammenhang zwischen Aluminium-Einlagerungen durch belastetes Trinkwasser und der Wahrscheinlichkeit, an Alzheimer zu erkranken, hergestellt.[67]
Laut einer gesundheitlichen Bewertung des Bundesinstitutes für Risikobewertung (BfR) im Jahre 2005 besteht kein Zusammenhang zwischen der Aluminiumaufnahme aus Lebensmittelbedarfsgegenständen und der Alzheimer-Krankheit.[68]
In vitro-Untersuchungen zeigten, dass das Antioxidans Epigallocatechingallat (EGCG) des Grünen Tees die Bildung von Plaques verhindern kann.[69] Andere Studien weisen darauf hin, dass EGCG die Plaque auch auflösen kann.[70] In Tierversuchen mit Mäusen konnte gezeigt werden, dass nach sechsmonatiger EGCG-Behandlung die Plaque-Belastung im Kortex, Hippocampus und im entorhinalen Kortex um jeweils 54 %, 43 % und 58 % reduziert wurde.[71] Eine weitere Studie, die die Auswirkung von EGCG auf die Alzheimer-Krankheit untersucht, wird an der Charité in Berlin durchgeführt.[72]
Medizinische Behandlung der erkrankten Menschen
Die Alzheimer-Krankheit kann bis heute nicht geheilt werden. Die positive Wirkung der derzeit zur Demenz-Behandlung zugelassenen Medikamenten auf bestehende Symptome ist nur relativ gering, sie können das Voranschreiten der Erkrankung nicht stoppen. Im Jahre 2006 wurde von der Amerikanischen Vereinigung für Geriatrische Psychiatrie ein Konsenspapier zur Alzheimer-Behandlung veröffentlicht.
Acetylcholinesterase-Hemmer
Die Medikamente sorgen dafür, dass Acetylcholin im Gehirn langsamer abgebaut wird und damit in höherer Konzentration vorliegt, dadurch soll der Verringerung des Acetylcholin-Niveaus durch das Absterben von Neuronen, die diesen Botenstoff produzieren, entgegengewirkt werden. Vertreter dieser Wirkstoffgruppe sind Galantamin, Donepezil und Rivastigmin. Zugelassen sind die Acetylcholinesterase-Hemmer bei leichter bis mittelschwerer Alzheimer-Demenz, nicht bei schwerer. Die Wirksamkeit der Therapie wird diskutiert. In der Ideal-Studie wird gezeigt, dass sowohl die Pflaster-Applikation als auch die orale Gabe von Rivastigmin die kognitiven Fähigkeiten der Patienten deutlich gegenüber Placebo verbessert wird.[73] Es gibt aber auch Studien, die eine geringe Wirkung der Acetylcholinesterase-Hemmer zeigen.[74] Unter deutschen Psychiatern ist das Ausmaß des Nutzens der Präparate daher umstritten.[75]
Ibuprofen und andere nichtsteroidale Entzündungshemmer
In retrospektiven Studien wurde bereits 1995 festgestellt,[76] dass Rheumapatienten ein signifikant reduziertes Risiko haben, die Alzheimer-Krankheit zu entwickeln, beziehungsweise bricht die Krankheit bei ihnen später als bei Nichtrheumatikern aus. Daraus wurde geschlossen, dass dieser Effekt auf die nichtsteroidalen Antirheumatika (NSAR) (in englischsprachigen Publikationen nonsteroidal anti-inflammatory drugs (NSAID) genannt) zurückzuführen ist, die diese Patienten einnehmen.[77][78]
In einigen transgenen Tiermodellen konnte eine Reduktion von Beta-Amyloid-Plaques bei der Gabe von Ibuprofen festgestellt werden.[79][80][81]
Beim Menschen liegen bisher keine Daten aus randomisierten Doppelblind-Studien vor, die eine gesicherte Wirkungsweise von Ibuprofen und anderen nichtsteroidalen Antirheumatika aufzeigen. Aufgrund der nicht unerheblichen Nebenwirkungen, die bei einer dauerhaften prophylaktischen Einnahme von Ibuprofen zu erwarten sind, wird von einer unkontrollierten Einnahme abgeraten.[82][83] Die zur möglichen Prävention der Alzheimer-Krankheit notwendigen Dosen an nichtsteroidalen Antirheumatika sind erheblich höher, als zur normalen Schmerzbehandlung. Die nichtsteroidalen Antirheumatika stehen in Verdacht kardiovaskuläre Probleme hervorzurufen, wenn sie auf Dauer und in hohen Dosen eingenommen werden.[84]
Mit Ibuprofen und Derivaten von Ibuprofen laufen zur Zeit eine Reihe klinischer Studien bei Alzheimer-Patienten.[85]
Aktivierung von ABC-Transportern
Neue Forschungsergebnisse von Jens Pahnke (Universität Rostock) sowie des von ihm geführten »Neurodegeneration Research Lab« (NRL)] zeigen auf, dass durch die Nutzung von Thiethylperazine und Thiethylperazine-Derivaten mit ABC-Transporter-aktivierender Wirkung eine Behandlung von neurodegenerativen Erkrankungen sowie die Funktion des Transporters ABCC1 zur Diagnostik und Therapieüberwachung von M. Alzheimer (und M. Parkinson) möglich ist. Durch diese Wirkstoffe kann der Verlauf der Alzheimer Demenz und des Morbus Parkinson um mehrere Jahre verzögert werden. Dieses bedeutet einen erheblichen Gewinn an fortdauernder Lebensqualität für die betroffenen Patienten als auch Kostenersparnis für das Gesundheitssystem. Bei dem von der Universität Rostock zum Patent angemeldeten Wirkstoff handelt es sich um eine Zweitindikation für ein bereits am Markt erhältliches Medikament (Torecan®). Pahnke hat diese Ergebnisse im »Journal of Clinical Investigation« veröffentlicht.[86]
NMDA-Rezeptor-Antagonist
Die Beeinflussung des Botenstoffes Glutamat, dem häufigsten erregenden Botenstoff im zentralen Nervensystem, der an Lernprozessen und Gedächtnisfunktionen beteiligt ist, wurde europaweit 2002 und in den USA 2003 zugelassen. Der bisher einzige Vertreter dieser Wirkstoffklasse ist Memantin. Dies ist ein NMDA-Rezeptor(N-Methyl-D-Aspartat)-Antagonist und soll die bei Alzheimer-Demenzen gestörte glutamaterge Signalweiterleitung normalisieren. Studienergebnisse zeigen, dass Memantin bei mittlerer bis schwerer Erkrankung nach sechs Monaten zu einer insgesamt geringfügigen Verbesserung der kognitiven Störungen und der beeinträchtigten Alltagsaktivitäten führt.[87] Zugelassen ist Memantin bei moderater bis schwerer Alzheimer-Demenz, nicht bei leichter.
Ginkgo biloba
Der Spezialextrakt EGb 761 ist zugelassen zur symptomatischen Behandlung von „hirnorganisch bedingten geistigen Leistungseinbußen bei demenziellen Syndromen". Als Standarddosis gelten 240 Milligramm täglich. Außer diesem Extrakt gibt es noch eine Vielzahl von anderen Ginkgo-biloba-haltigen Präparaten, die sich in ihrer exakten Zusammensetzung unterscheiden. Eine Meta-Analyse der vorliegenden Studienergebnisse aus dem Jahre 2007 kam zu dem Schluss, dass die Hinweise auf einen günstigen Einfluss von Ginkgo-Präparaten auf die kognitiven Fähigkeiten von Alzheimer-Patienten unschlüssig und wenig überzeugend seien;[88] in einer vorangegangenen Publikation hatten dieselben Autoren Ginkgo als vielversprechend beschrieben.[89]
In den USA wurde eine große doppeltblinde Langzeit-Studie (GEM-Studie) durchgeführt, die klären sollte, ob Ginkgo effektiv zur Prävention von Alzheimer eingesetzt werden kann.[90] Die im Jahre 2008 veröffentlichten Resultate ergaben keinen signifikanten Unterschied zwischen dem Ginkgo-Präparat (2× täglich 120 mg) und Placebo – während in der Placebo-Gruppe 246 Personen eine Demenz entwickelten, waren es in der Ginkgo-Gruppe 277 Personen.[91]Eine weitere Analyse der GEM-Studie, Ende 2009 publiziert, ergab zudem, dass der Spezialextrakt bei den durchschnittlich knapp 80-jährigen Patienten einen mentalen Leistungsverlust nicht aufhalten konnte.[92] Die Autoren der Studie weisen in ihrer Diskussion der Ergebnisse zum einen darauf hin, dass die verwendeten kognitiven Tests möglicherweise nicht geeignet waren, um Effekte des Präparats erkennen zu können. Zum anderen sollen die Studienteilnehmer ungewöhnlich gesund und gebildet gewesen sein, was das Auftreten kognitiver Leistungsschwächen relativ unwahrscheinlich mache. Eine Literatur-Analyse von Wissenschaftlern der Charité kam 2010 zu dem Schluss, dass der Spezialextrakt zwar wirksamer sei als Placebo, der Effekt jedoch moderat ausfalle und die klinische Bedeutung dieses Effektes wie generell bei Antidementiva sehr schwer zu bestimmen sei.[93]
Das deutsche Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen untersuchte 2008 im Rahmen einer Arzneimittelbewertung öffentlich zugängliche Studien sowie von Arzneimittelherstellern zur Verfügung gestellten Daten der in Deutschland verfügbaren ginkgohaltigen Präparate. Es kam zu dem Schluss, dass es einen Beleg für einen Nutzen beim Therapieziel „Aktivitäten des täglichen Lebens“ gebe, sofern 240 mg Extrakt täglich eingenommen werden. Für die Therapieziele „kognitive Fähigkeiten“ und „allgemeine psychopathologische Symptome“ sowie für das angehörigenrelevante Therapieziel „Lebensqualität der (betreuenden) Angehörigen“ (gemessen am emotionalen Stress der Angehörigen) gebe es bei der selben Dosierung nur einen Hinweis auf einen Nutzen.[94]
In der Literatur gibt es Hinweise darauf, dass eine hohe Dosis von Ginkgo-Extrakt zu einer Schädigung der roten Blutkörperchen führen kann. Deshalb sollte die Einnahme von 120 mg Extrakt täglich nicht überschritten werden. Weitere Studien deuten darauf hin, dass Ginkgo-Blätter pharmakologisch wirksamere Substanzen enthalten, die möglicherweise eine ursächliche Behandlung der präklinischen Alzheimer-Demenz zulassen.[95]
Insulin
Beachtenswert ist der Effekt, dass Insulin, verabreicht als Nasenspray in direktem Kontakt mit den ZNS, die Alzheimer-Krankheit positiv beeinflussen kann. [96]
Psychologische Behandlung
Symptome wie innere Unruhe, depressive Verstimmung oder Erregung und Aggressivität, die im Verlauf der Krankheit möglicherweise auftreten, können mit Hilfe von Psychotherapie und Psychopharmaka behandelt werden. Daneben werden seit Beginn des 21. Jahrhunderts zunehmend nicht-pharmakologische Interventionen bei Verhaltensstörungen von Demenzkranken favorisiert.[97]
Verhaltensrichtlinien
Eine amerikanische Studie ergab, dass Personen, die zwischen ihrem 20. und 50. Lebensjahr eine geistig wenig anspruchsvolle Tätigkeit ausgeübt hatten, häufiger an Alzheimer erkranken. Möglicherweise wird die Schwelle, an der Symptome erkennbar werden, hinaufgesetzt.[98]
Aktuelle wissenschaftliche Arbeiten lassen vermuten, dass bereits leichte, aber regelmäßige körperliche Aktivität (Spazierengehen, Gartenarbeit) vielleicht vor der Entwicklung einer Alzheimer-Demenz schützen.[99] Es wird angenommen, dass die positiven Einflüsse der Bewegung auf vaskuläre Risikofaktoren (Bluthochdruck, Fettstoffwechselstörungen und Diabetes mellitus) vaskulär bedingte Schäden im Gehirn reduzieren und so - indirekt - das Auftreten von Demenz-Symptomen behindern.[100]
Die Anpassung der Lebensräume an die veränderten Möglichkeiten und Bedürfnisse können den Alltag von Betroffenen und Pflegekräften erleichtern. Die Vereinfachung von Tätigkeitsabläufen und das Beschriften von Gegenständen helfen dem Patienten dabei, ein höheres Maß an Unabhängigkeit zu erhalten. Veränderungen der bekannten Abläufe oder der Umgebung regen die Patienten oft unnötig auf, während gut ausgeleuchtete Räume, angemessene Pausen und begrenzte Anforderungen dem Patienten ein sicheres Gefühl geben. Angemessene soziale und visuelle Stimulation kann zu einer Verbesserung der Aufmerksamkeit und Orientierung führen, beispielsweise kann eine Steigerung der Nahrungsaufnahme erreicht werden, wenn auffallend farbige Tisch-Accessoires verwendet werden, die Alzheimer-Patienten mit verminderter Kontrasterkennung besser wahrnehmen können.[101]
Gesellschaftliche Wahrnehmung
In den 1970er Jahren begann man, offener über Alterserkrankungen zu sprechen. Erkrankungen von Prominenten wie Rita Hayworth († 1987), Charles Bronson († 2003), Helmut Zacharias († 2002) und Peter Falk († 2011) machten bewusst, dass es ‚jeden treffen kann‘. Ronald Reagan, US-Präsident von 1981 bis 1989, bekannte sich 1994 (mit 83 Jahren) in einem Brief an die amerikanische Öffentlichkeit zu seiner Alzheimer-Erkrankung: „Ich beginne nun die Reise, die mich zum Sonnenuntergang meines Lebens führt, in der Gewissheit, dass über Amerika immer wieder ein strahlender Morgen heraufdämmern wird.“ Reagan starb zehn Jahre nach der Diagnose.
Im März 2008 machte Tilman Jens die Demenz vom Alzheimer Typ seines Vaters Walter Jens öffentlich.[102] Zwei Monate später brachte Ursula von der Leyen die Alzheimer-Krankheit ihres Vaters, des ehemaligen niedersächsischen Ministerpräsidenten Ernst Albrecht, in die Öffentlichkeit.[103]
Inzwischen wissen viele, dass die Alzheimer-Krankheit in 50 bis 80 Prozent der Fälle die häufigste Form geistigen Verfalls ist. An zweiter Stelle steht die gefäßbedingte Demenz: Durchblutungsstörungen durch Schlaganfälle oder verengte und verkalkte Schlagadern können das Gehirn so weit zerstören, dass eine Demenz auftritt. Häufig überlagern sich die beiden Demenz-Arten.
Der Suizid von Gunter Sachs lenkte im Mai 2011 erneut die öffentliche Aufmerksamkeit auf dieses Thema.[104]
Die Alzheimer-Krankheit gilt auch als eine Belastung für das Gesundheitssystem. Da die Zahl sehr alter Menschen stark zugenommen hat und weiter zunimmt, nimmt die Zahl der Erkrankten immer weiter zu. Die Behandlung zu bezahlen, ist für Krankenkassen und Pflegekasse eine wachsende finanzielle Herausforderung.[105]
Siehe auch
Literatur
- Alois Alzheimer: Über eine eigenartige Erkrankung der Hirnrinde. Vortrag [3. November] auf der Versammlung Südwestdeutscher Irrenärzte in Tübingen am 3. und 4. November 1906. Eigenbericht Alzheimers in Allg. Zeitschrift für Psychiatrie und psychisch-gerichtliche Medizin, 1907, S. 146–148
- T. A. Bayer, O. Wirths: Alzheimer-Demenz. Molekulare Pathologie, Tiermodelle und Therapiestrategien. In: Der Nervenarzt, 79 (Suppl 3), S. 117–128.
- Anne Eckert: Alois Alzheimer und die Alzheimer Krankheit. In: Pharmazie in unserer Zeit. Band 31 (4), 2002, S. 356–360, ISSN 0048-3664.
- Hans Förstl, Alexander Kurz und Tobias Hartmann: Alzheimer-Demenz. In: Hans Förstl (Hg.): Demenzen in Theorie und Praxis. 3., aktualisierte und überarb. Aufl. Speinger, Berlin [u.a.] 2011, ISBN 978-3-642-19794-9, S. 47–72.
- Kurt Jellinger (Hrsg.): Alzheimer – Meilensteine aus hundert Jahren wissenschaftlicher und klinischer Forschung. Akademische Verlagsgesellschaft AKA, Berlin 2006, ISBN 3-89838-077-7.
Weblinks
 Wikiversity: Erstbeschreibung der Alzheimerschen Erkrankung – Kursmaterialien, Forschungsprojekte und wissenschaftlicher Austausch
Wikiversity: Erstbeschreibung der Alzheimerschen Erkrankung – Kursmaterialien, Forschungsprojekte und wissenschaftlicher Austausch- Deutsche Alzheimer Gesellschaft e. V.
- Makroskopisches Präparat eines Alzheimer-Patienten und histologisches Präparat
- Quarks & Co zum Thema Alzheimer - Skript und Sendung
- Wegweiser Demenz des Bundesministeriums für Familie, Senioren, Frauen und Jugend
- Morbus Alzheimer – Wenn einem die Welt verloren geht
- Dokumentation "Die großen Volkskrankheiten - Alzheimer" als Video in Programm »Das Erste Mediathek« von der ARD, eingesehen am 5. August 2011
- Alzheimer-Therapie: Forscher wollen spezialisierte Zellen des Immunsystems nutzen
- Wirkung der ABC-Transporter bei Alzheimer
- RTL zu aktuellen Forschungsergebnissen
Einzelnachweise
- ↑ C. P. Ferri, M. Prince, C. Brayne et al.: Global prevalence of dementia: a Delphi consensus study. In: Lancet. 366, Nr. 9503, 2005, S. 2112-7. doi:10.1016/S0140-6736(05)67889-0. PMID 16360788.
- ↑ A. Alzheimer: Uber eine eigenartige Erkrankung der Hirnrinde.. In: Allg. Z. Psychiat. Psych.-Gerichtl. Med.. 64, Nr. 1-2, 1907, S. 146–148.
- ↑ Konrad Maurer, Ulrike Maurer: Alzheimer: the life of a physician and the career of a disease. New York: Columbia University Press 2003, ISBN 0-231-11896-1
- ↑ Fred H. Hochberg, David Rottenberg: Neurological classics in modern translation. New York: Hafner Press 1977, ISBN 0-02-851180-8
- ↑ N. C. Berchtold, C. W. Cotman: Evolution in the conceptualization of dementia and Alzheimer's disease: Greco-Roman period to the 1960s. In: Neurobiol. Aging. 19, Nr. 3, 1998, S. 173–189. PMID 9661992.
- ↑ Emil Kraepelin: Textbook of Psychiatry 1910
- ↑ M. B. Graeber, S. Koesel, R. Egensperger, R. B. Banati, U. Mueller, K. Bise, P. Hoff, H. J. Moeller, K. Fujisawa, P. Mehraein: Rediscovery of the case described by Alois Alzheimer in 1911: historical, histological and molecular genetic analysis. journal = Neurogenetics. 1, 1997, S. 73–80.
- ↑ Skript der Sendung Quarks & Co zum Thema Alzheimer
- ↑ http://www.wegweiser-demenz.de/gesellschaft-und-demenz.html
- ↑ http://www.derwesten.de/nachrichten/Viele-scheuen-bei-Demenz-den-Gang-zum-Arzt-id3738233.html
- ↑ R. Brookmeyer u. a.: Forecasting the global burden of Alzheimer’s disease. In: Alzheimer's and Dementia. 3/2007, Band 3, S.186–191
- ↑ M. Schäfer:Forscher: Alzheimer wird zum Massenphänomen In: wissenschaft.de vom 11. Juni 2007
- ↑ http://www.nature.com/ng/journal/vaop/ncurrent/abs/ng1943.html Peter St George-Hyslop et al.: The neuronal sortilin-related receptor SORL1 is genetically associated with Alzheimer disease. Published online: 14 January 2007; | doi:10.1038/ng1943
- ↑ Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, et al. (2010): The Alzheimer's Disease-Associated Amyloid β-Protein Is an Antimicrobial Peptide. PLoS ONE 5(3): e9505. doi:10.1371/journal.pone.0009505
- ↑ Zukunftsmusik? Impfen gegen das Vergessen. Alzheimer Forschung Initiative e. V., 6. Oktober 2010, abgerufen am 6. November 2010.
- ↑ Antikörper löst Amyloid bei Alzheimer-Patienten. Ärzte Zeitung, 21. Mai 2010, abgerufen am 6. November 2010.
- ↑ Oliver Wirths u. a.: Identification of low molecular weight pyroglutamate abeta oligomers in Alzheimer disease: A novel tool for therapy and diagnosis, Journal of Biological Chemistry online, 22. Oktober 2010, Volltext
- ↑ Neuer Therapie gegen Alzheimer: Göttinger Forscher entwickeln neuen Ansatz für passive Immunisierung. Informationsdienst Wissenschaft (idw), 5. November 2010, abgerufen am 6. November 2010.
- ↑ National Institut on Aging: The Seven Warning Signs of Alzheimer's Desease. Englisch
- ↑ R. T. Linn, P. A. Wolf, D. L. Bachman et al.: The 'preclinical phase' of probable Alzheimer's disease. A 13-year prospective study of the Framingham cohort. In: Arch. Neurol.. 52, Nr. 5, 1995, S. 485–490. PMID 7733843.
- ↑ J. Saxton, O. L. Lopez, G. Ratcliff et al.: Preclinical Alzheimer disease: neuropsychological test performance 1.5 to 8 years prior to onset. In: Neurology. 63, Nr. 12, 2004, S. 2341–2347. PMID 15623697.
- ↑ E. W. Twamley, S. A. Ropacki, M. W. Bondi: Neuropsychological and neuroimaging changes in preclinical Alzheimer's disease. In: J Int Neuropsychol Soc. 12, Nr. 5, 2006, S. 707–735. doi:10.1017/S1355617706060863. PMID 16961952.
- ↑ a b H. Förstl, A. Kurz: Clinical features of Alzheimer's disease. In: Eur Arch Psychiatry Clin Neurosci. 249, Nr. 6, 1999, S. 288–290. PMID 10653284.
- ↑ G. A. Carlesimo, M. Oscar-Berman: Memory deficits in Alzheimer's patients: a comprehensive review. In: Neuropsychol Rev. 3, Nr. 2, 1992, S. 119–169. PMID 1300219.
- ↑ M. Jelicic, A. E. Bonebakker, B. Bonke: Implicit memory performance of patients with Alzheimer's disease: a brief review. In: Int Psychogeriatr. 7, Nr. 3, 1995, S. 385–392. PMID 8821346.
- ↑ E. M. Frank: Effect of Alzheimer's disease on communication function. In: J S C Med Assoc. 90, Nr. 9, 1994, S. 417–423. PMID 7967534.
- ↑ J. T. Becker, A. A. Overman: [The semantic memory deficit in Alzheimer's disease]. In: Rev Neurol. 35, Nr. 8, 2002, S. 777–783. PMID 12402233.
- ↑ J. R. Hodges, K. Patterson: Is semantic memory consistently impaired early in the course of Alzheimer's disease? Neuroanatomical and diagnostic implications. In: Neuropsychologia. 33, Nr. 4, 1995, S. 441–459. PMID 7617154.
- ↑ T. Benke: Two forms of apraxia in Alzheimer's disease. In: Cortex. 29, Nr. 4, 1993, S. 715–725. PMID 8124945.
- ↑ Liz Kumru: Getting Lost in Alzheimer's. UNMC. Zugriff am 22. Juli 2007
- ↑ Tom Rickey: Road Skills Hint at „Motion Blindness“ of Alzheimer's. 31. Januar 2002. Zugriff am 21. Juli 2007
- ↑ Clifford R. Jack, Jr. et al.: Introduction to the recommendations from the National Institute on Aging and the Alzheimer’s Association workgroup on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer's & Dementia: The Journal of the Alzheimer's Association. Mai 2011. Band 7, Ausgabe 3, Seiten 257-262
- ↑ Giovanni B. Frisoni, Harald Hampel et al.: Revised criteria for Alzheimer’s disease: what are the lessons for clinicians? In: The Lancet Neurology. Juli 2011. Band 10. Seiten 598 - 601
- ↑ Sperling Reisa A. et al.: Toward defining the preclinical stages of Alzheimer’s disease: Recommendations from the National Institute on Aging and the Alzheimer’s Association workgroup. In: Alzheimer's & Dementia: The Journal of the Alzheimer's Association. Mai 2011. Band 7, Ausgabe 3
- ↑ a b Albert Marilyn S. et al.: The diagnosis of mild cognitive impairment due to Alzheimer’s disease: Recommendations from the National Institute on Aging and Alzheimer’s Association workgroup. In: Alzheimer's & Dementia: The Journal of the Alzheimer's Association. Mai 2011. Band 7, Ausgabe 3
- ↑ McKhann Guy M. et al.: The diagnosis of dementia due to Alzheimer’s disease: Recommendations from the National Institute on Aging and the Alzheimer’s Association workgroup. In: Alzheimer's & Dementia: The Journal of the Alzheimer's Association. Mai 2011. Band 7, Ausgabe 3
- ↑ H.-J. Gertz und A. Kurz: Diagnose ohne Therapie. Frühdiagnostik der Alzheimer-Krankheit im Stadium der leichten kognitiven Beeinträchtigung. In: Der Nervenarzt. 10.1007/s00115-010-3213-3
- ↑ Henryk Barthel et al.: Cerebral amyloid-β PET with florbetaben (18F) in patients with Alzheimer's disease and healthy controls: a multicentre phase 2 diagnostic study. In: The Lancet Neurology. Mai 2011. Band 10, Ausgabe 5, Seiten 424-435
- ↑ Thomas Hauser et al.: Mild cognitive impairment. Diagnostische Wertigkeit verschiedener MRT-Techniken. In: Der Radiologie. 2011; 51:285–292 DOI 10.1007/s00117-010-2094-6
- ↑ Mucke, L.: Neuroscience: Alzheimer's disease. In: Nature. 461, 2009, S. 895-897. PMID 19829367.
- ↑ Gary W. Small: What we need to know about age related memory loss. In: British Medical Journal. 22. Juni 2002, S. 1502–1507. Abgerufen am 5. November 2006.
- ↑ M. Z. Scalco et al.: Prevention of Alzheimer disease. Encouraging evidence. In: Can Fam Physician. 2006, S. 200–207
- ↑ Artikel in wissenschaft.de „Äpfel fürs Hirn“
- ↑ Artikel in wissenschaft.de „Fischöl gegen das Vergessen“
- ↑ M. Morris, J. Schneider, C. Tangney: Thoughts on B-vitamins and dementia.. In: J Alzheimers Dis. 9, Nr. 4, 2006, S. 429–433. PMID 16917152.
- ↑ Inna I. Kruman1, T. S. Kumaravel2, Althaf Lohani2, Ward A. Pedersen1, Roy G. Cutler1, Yuri Kruman1, Norman Haughey1, Jaewon Lee1, Michele Evans2, and Mark P. Mattson1, 3: Folic Acid Deficiency and Homocysteine Impair DNA Repair in Hippocampal Neurons and Sensitize Them to Amyloid Toxicity in Experimental Models of Alzheimer's Disease.. In: The Journal of Neuroscience,. 22, Nr. 5, March 1, 2002.. Einen vereinfachten Bericht findet man hier: www.alzheimers.org.uk
- ↑ „Folate May Lower Alzheimer's Risk“ CBS news, reporting from WebMD
- ↑ National Institute of Health – Folic Acid Possibly A Key Factor In Alzheimer's Disease Prevention
- ↑ K. Fackelmann: Folate shows promise in preventing Alzheimer's. In: USA Today vom 14. August 2005
- ↑ Artikel in wissenschaft.de „Raucher-Ausrede widerlegt“
- ↑ Zylberstein et al.: Midlife homocysteine and late-life dementia in women. A prospective population study Neurobiol Aging. (2011) Mar;32(3):380-6, PMID 19342123
- ↑ Smith et al.: Homocysteine-lowering by B vitamins slows the rate of accelerated brain atrophy in mild cognitive impairment: a randomized controlled trial PLoS One. (2010) Sep 8;5(9), PMID 20838622
- ↑ Artikel in wissenschaft.de „Bildung schützt vor Alzheimer“
- ↑ Roy Eccleston: Think or sink. In: The Weekend Australian Magazine. 2-3 Dezember 2006, abgerufen am 3. Januar 2009.
- ↑ Kreuzworträtsel lösen reicht nicht. In: GesundheitPro.de. 8. November 2007, abgerufen am 3. Januar 2009.
- ↑ Artikel in telepolis.de „Fernsehen macht blöd“
- ↑ wissenschaft.de: Blutdruck senkende Mittel können Demenz vorbeugen. Ausgabe vom 14. Februar 2002
- ↑ A. Brüning: Wie Cholesterin das Risiko für Alzheimer erhöht. In: Berliner Zeitung, vom 11. Oktober 2005
- ↑ R. Mayeux, R. Ottman, M. Tang, L. Noboa-Bauza, K. Marder, B. Gurland, Y. Stern: Genetic susceptibility and head injury as risk factors for Alzheimer's disease among community-dwelling elderly persons and their first-degree relatives. In: Ann. Neurol.. 33, Nr. 5, 1993, S. 494–501. PMID 8498827.
- ↑ Neumann KF, Rojo L, Navarrete LP, Farías G, Reyes P, Maccioni RB: Insulin resistance and Alzheimer's disease: molecular links & clinical implications.. In: Curr Alzheimer Res.:. Nr. 5(5), Oct 2008, S. 438-447. PMID 18855585.
- ↑ S Roriz-Filho J, Sá-Roriz TM, Rosset I, Camozzato AL, Santos AC, Chaves ML, Moriguti JC, Roriz-Cruz M.: (Pre)diabetes, brain aging, and cognition.. In: Biochim Biophys Acta. 2009 May;1792(5):432-43. Epub 2008 Dec 16. . PMID 19135149.
- ↑ Qiu WQ, Folstein MF: Insulin, insulin-degrading enzyme and amyloid-beta peptide in Alzheimer's disease: review and hypothesis.. In: Neurobiol Aging. 2006 Feb;27(2):190-8. Epub 2005 Feb 17. . PMID 19135149.
- ↑ O. S. Kofman, V. H. MacMillan: Diffuse Cerebral Atrophy.. In: Applied Therapeutics. 12, Nr. 4, 1970, S. 24–26.
- ↑ M. Crisby, L. Carlson, B. Winblad: Statins in the prevention and treatment of Alzheimer disease. In: Alzheimer disease and associated disorders. 16, Nr. 3, 2002, S. 131–136. PMID 12218642.
- ↑ P. Kehoe, G. Wilcock: Is inhibition of the renin-angiotensin system a new treatment option for Alzheimer's disease?. In: Lancet neurology. 6, Nr. 4, 2007, S. 373–378. PMID 17362841.
- ↑ „Why stroke ups Alzheimer's risk“ BBC, vom 4. Juni 2007
- ↑ Virginie Rondeau, Daniel Commenges, Hélène Jacqmin-Gadda, Jean-François Dartigues: Relation between Aluminum Concentrations in Drinking Water and Alzheimer's Disease: An 8-year Follow-up Study.. In: Am J Epidemiology. 2000. PMID 10901330.
- ↑ Bundesinstituts für Risikobewertung: Keine Alzheimer-Gefahr durch Aluminium aus… (PDF-Datei)
- ↑ J. P. Guo, S. Yu, PL. McGeer: Simple in vitro assays to identify amyloid-beta aggregation blockers for Alzheimer's disease therapy.. In: J Alzheimers Dis. 19, Nr. 4, 2010, S. 1359–1370. PMID 20061605.
- ↑ D. E. Ehrnhoefer, J. Bieschke et al.: EGCG redirects amyloidogenic polypeptides into unstructured, off-pathway oligomers.. In: Nat Struct Mol Biol.. 15, Nr. 5, Juni 2008, S. 558–566. PMID 18511942.
- ↑ K. Rezai-Zadeh, G. W. Arendash et al.: Green tea epigallocatechin-3-gallate (EGCG) reduces beta-amyloid mediated cognitive impairment and modulates tau pathology in Alzheimer transgenic mice.. In: Brain Res.. 12, Nr. 1214, Juni 2008, S. 177–186. PMID 18457818.
- ↑ „Wie greift EGCG in den Mechanismus der Amyoidbildung ein?“
- ↑ http://www.ncbi.nlm.nih.gov/pubmed/17380489?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_RVAbstractPlusDrugs1
- ↑ H. Kaduszkiewicz, T. Zimmermann, H. P. Beck-Bornholdt, H. van den Bussche: Cholinesterase inhibitors for patients with Alzheimer's disease: systematic review of randomised clinical trials. In: BMJ (Clinical Research Ed.). 331, Nr. 7512, August 2005, S. 321–327. PMID 16081444. Volltext bei PMC: 1183129. Abgerufen am 30. September 2010.
- ↑ Thomas Lempert und Tom Bischor: Nervenarzt 2011, Januar 2011, 82:90–92 DOI 10.1007/s00115-010-3233-z
- ↑ S. G. Post: Delayed onset of Alzheimer's disease with nonsteroidal anti-inflammatory and histamine H2 blocking drugs. In: Neurobiology of Aging 16/1995, S. 523–30.
- ↑ T. Wyss-Coray, L. Mucke: Ibuprofen, inflammation and Alzheimer disease. In: Nature Medicine 6/2000, S. 973–974
- ↑ D. Dokmeci: Ibuprofen and Alzheimer's disease. In: Folia Med (Plovdiv) 46/2004, S. 5–10, PMID 15506544
- ↑ M. Takashi u. a.: Ibuprofen Suppresses Interleukin-1bold italic beta Induction of Pro-Amyloidogenic alpha1-Antichymotrypsin to Ameliorate bold italic beta-Amyloid (Abold italic beta) Pathology in Alzheimer's Models. In: Neuropsychopharmacology 30/2005, S. 1111–1120.
- ↑ A. C. McKee u. a.: Ibuprofen reduces Abeta, hyperphosphorylated tau and memory deficits in Alzheimer mice. In: Brain Res. 16. Februar 2008 (Epub ahead of print) PMID 18374906
- ↑ M. Sastre u. a.: Nonsteroidal anti-inflammatory drugs repress beta-secretase gene promoter activity by the activation of PPARgamma. In: Proc Natl Acad Sci U S A. 103/2006, S. 443–448, PMID 16407166
- ↑ N. Tabet, H. Feldmand: Ibuprofen for Alzheimer's disease. In: Cochrane Database Syst Rev 2/2003, CD004031. PMID 12804498
- ↑ B. DeStrooper, G. König: Alzheimer's disease: An inflammatory drug prospect. In: Nature 414/2001, S. 159–60.
- ↑ Gregor Larbig: Studien zur Identifizierung & Optimierung potentieller Wirkstoffe für die Behandlung von Morbus Alzheimer. Dissertation, TU Darmstadt, 2007
- ↑ T. Müller: Neue Wege gegen das Amyloid im Hirn. In: Ärzte Zeitung 7. Dezember 2007
- ↑ »Journal of Clinical Investigation«, Ausgabe September 2011 (Cerebral amyloid-β proteostasis is regulated by the membrane transport protein ABCC1 in mice)
- ↑ R. McShane, A. Areosa Sastre, N. Minakaran: Memantine for dementia. Cochrane Database Syst Rev. 2006 Apr 19;(2):CD003154. PMID 16625572
- ↑ J. Birks, Evans J. Grimley: Ginkgo biloba for cognitive impairment and dementia. In: Cochrane Database Syst Rev. Nr. 2, 2007, S. CD003120. doi:10.1002/14651858.CD003120.pub2. PMID 17443523. Abgerufen am 23. Januar 2008.
- ↑ J. Birks, E. Grimley, M. Van Dongen: Ginkgo biloba for cognitive impairment and dementia.. In: Cochrane Database Syst Rev. , S. CD003120. PMID 12519586.
- ↑ S. T. DeKosky, A. Fitzpatrick, D. G. Ives, J. Saxton, J. Williamson, O. L. Lopez, G. Burke, L. Fried, L. H. Kuller, J. Robbins, R. Tracy, N. Woolard, L. Dunn, R. Kronmal, R. Nahin, C. Furberg: The Ginkgo Evaluation of Memory (GEM) study: design and baseline data of a randomized trial of Ginkgo biloba extract in prevention of dementia. In: Contemp Clin Trials. 27, Nr. 3, 2006, S. 238–253. doi:10.1016/j.cct.2006.02.007. PMID 16627007. Abgerufen am 23. Januar 2008.
- ↑ Resultat der GEM Studie
- ↑ Beth E. Snitz et al.: Ginkgo biloba for Preventing Cognitive Decline in Older Adults: A Randomized Trial. In: JAMA. 2009;302(24):2663-2670
- ↑ Stefan Weinmann et al: Effects of Ginkgo biloba in dementia: systematic review and meta-analysis. In: BMC Geriatrics 2010, 10:14
- ↑ Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen: Abschlussbericht "Ginkgohaltige Präparate bei Alzheimer Demenz". Veröffentlichung am 21. November 2008. http://www.iqwig.de/download/A05-19B_Abschlussbericht_Ginkgohaltige_Praeparate_bei_Alzheimer_Demenz.pdf]
- ↑ B. Kastenholz: Phytopharmaceuticals in the therapy of younger Alzheimer patients. WebmedCentral AGING 2011;2(7):WMC002011.
- ↑ Craft S, Intranasal Insulin Therapy for Alzheimer Disease, Arch Neurol. 2011 Sep 12.
- ↑ J. Cohen-Mansfield: Nonpharmacologic interventions for inappropriate behaviors in dementia: a review, summary, and critique. In: Am J Geriatr Psychiatry 9 (4), 2001, S. 361–381. PMID 11739063 (Review)
- ↑ (BBC News August 2004)
- ↑ Laura E. Middleton et al.: Activity Energy Expenditure and Incident Cognitive Impairment in Older Adults. Arch Intern Med. 2011;171(14):1251-1257. 19. Juli 2011. doi:10.1001/archinternmed.2011.277
- ↑ Marie-Noel Vercambre et al.; Physical Activity and Cognition in Women With Vascular Conditions. Arch Intern Med. 2011;171(14):1244-1250. 19. Juli 2011. doi:10.1001/archinternmed.2011.282
- ↑ T. E. Dunne, S. A. Neargarder, P. B. Cipolloni, A. Cronin-Golomb: Visual contrast enhances food and liquid intake in advanced Alzheimer's disease. In: Clin Nutr. 23, Nr. 4, 2004, S. 533–538. PMID 15297089.
- ↑ Tilman Jens: Vaters Vergessen. In: F. A. Z., 4. März 2008, Nr. 54, Seite 37.
- ↑ Von der Leyen und die Krankheit ihres Vaters. Ein Artikel über die Sendung auf www.welt.de, 27. Mai 2008.
- ↑ Zum Beispiel Titelthema in »Die Zeit« vom 12. Mai 2011: Die Angst vor Alzheimer
- ↑ »Medical Ttribune« 36/2009, eingesehen am 7. Juli 2011

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.