- Mykobakterium
-
Mycobacterium 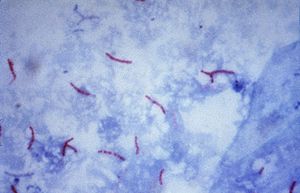
Mycobacterium tuberculosis (Ziehl-Neelsen-Färbung)
Systematik Domäne: Bakterien (Bacteria) Abteilung: Actinobacteria Ordnung: Actinomycetales Familie: Mycobacteriaceae Gattung: Mycobacterium Wissenschaftlicher Name Mycobacterium Lehmann & Neumann 1896 Die Mykobakterien (Mycobacterium) bilden eine Gattung mit um die 100 Arten. Sie sind die einzigen Vertreter der Familie Mycobacteriaceae. Zu ihnen gehören Krankheitserreger des Menschen wie Mycobacterium tuberculosis (Tuberkulose) und Mycobacterium leprae (Lepra), Krankheitserreger von Tieren wie der Erreger der Rindertuberkulose (Mycobacterium bovis), aber auch freilebende Arten.
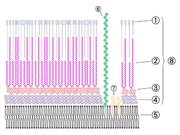
Mykobakterien sind mit der Gram-Färbung schlecht anzufärben, ihr Zellwandaufbau entspricht aber weitgehend dem Wandaufbau grampositiver Bakterien, d. h. die Zellwand besitzt keine äußere Membran und besteht aus einem mehrschichtigen Peptidoglykan (Murein). Die Einordnung zu den grampositiven Bakterien wurde auch durch RNA-Analysen bestätigt. Aufgrund des hohen GC-Gehaltes in ihrer DNA werden sie zu den Actinobacteria, einer Abteilung von grampositiven Bakterien, gestellt.
Inhaltsverzeichnis
Allgemeine Merkmale
Mykobakterien sind meist stäbchenförmig und bilden nur selten in älteren Kulturen Verzweigungen, die dann oft wieder in Kokken (Kugelbakterien) oder Stäbchen zerfallen. Im Gegensatz hierzu bildet die Mehrzahl der Aktinomyzeten verzweigte Mycelien, die den von Pilzen gebildeten Mycelien gleichen, man spricht von den filamentösen Aktinomyzeten. Auf dieser Eigenschaft beruht auch der Name, Aktinomyzeten bedeutet soviel wie „Strahlenpilze“ (griechisch „aktis“ für Strahl und „mykes“ für Pilz).
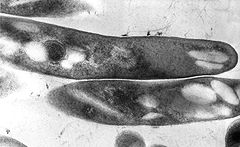
Mykobakterien sind durchweg aerob, der Stoffwechsel ist chemoorganotroph, d. h. sie benötigen Sauerstoff und organische Stoffe zum Energiegewinn. Sie bilden keine Sporen und sind zur aktiven Bewegung unfähig. Weitere Merkmale sind die Säurefestigkeit, die durch die Ziehl-Neelsen-Färbung nachweisbar ist, und langsames Wachstum. Mykobakterien nutzen u.a. Triacylglycerine (Neutralfette, TAGs) als Reservestoffe[1]. Diese Neutrralfette werden in Granula, so genannten „fat bodies“, innerhalb des Zellkörpers angehäuft[2]. Triacylglycerine als Speicherlipide sind bei Eukaryoten, wie Hefen oder Pilze, weit verbreitet, unter den Bakterien sind sie allerdings seltener anzutreffen. Vor allem bei den Actinomycetales, wie Mycobacterium, Streptomyces, Rhodococcus und Nocardia, ist die intracelluläre Akkumulation von TAGs nachgewiesen[3].
Auch bestimmte Wachse, so genannte Wachsester, werden von einigen Vertretern der Actinomycetalen als Speicherstoffe genutzt[3]. Bei den Mykobakterien wurden sie z.B. bei Mycobacterium tuberculosis gefunden. Wachsester als Reservestoffe treten im Bakterienreich eher selten auf, außer bei den Actinomycetales wurden sie z. B. noch bei Moraxella und Alcanivorax, beides den Proteobakterien zugehörig, nachgewiesen[3]. Wachsester als Reservestoffe sind bei den Eukaryoten kaum anzutreffen, z.B. in Samen der Jojoba-Pflanze. Auch Glykogen und Trehalose werden als mögliche Speicherstoffe der Mykobakterien angesehen[2].
Viele der nichttuberkulösen Mykobakterien, wie z. B. Mycobacterium fortuitum leben als Saprophyten frei in der Umwelt (Böden, auch Süßgewässer und Meere). Die normalerweise freilebenden Bakterien können unter Umständen bei Menschen mit geschwächtem Immunsystem Krankheiten verursachen (fakultativ pathogen). Einige sind auch gefährliche Krankheitserreger für Tiere und können in der Tierhaltung bzw. Landwirtschaft große Probleme verursachen. Mycobacterium avium zählt zu den nichttuberkulösen Mykobakterien und löst die Geflügeltuberkulose bei Vögeln aus, kann aber beim Menschen auch Lungenerkrankungen verursachen. Mycobacterium bovis zählt zum Mycobacterium tuberculosis-Komplex und ist in erster Linie für Kühe als Tuberkuloseerreger gefährlich, kann aber auch auf den Menschen übertragen werden.
Die meisten Vertreter des obligat pathogenen Mycobacterium tuberculosis-Komplexes leben als obligat intrazelluläre Parasiten in Makrophagen. Virulenzfaktoren sind nicht bekannt, allerdings schützt ihr besonderer Wandaufbau, der wachsartige Substanzen und Mykolsäuren enthält, vor äußeren Einflüssen. Die Lipide der Zellwand sind auch Ursache der charakteristischen Säurefestigkeit.
Der Wandaufbau verhindert auch einen schnellen Stoffaustausch mit der Umgebung und verursacht dadurch ein nur langsames Wachstum und eine nur langsame Vermehrung. Dieses im Vergleich zu anderen Bakterien äußerst langsame Wachstum ist charakteristisch für alle Mykobakterien. In Bezug auf die Wachstumsgeschwindigkeit werden die Mykobakterien in zwei Gruppen unterteilt: Die langsamwachsenden („slow growers“) mit einer Generationszeit von 6–24 Stunden in Laborkulturen und die schnellwachsenden („rapid growers“) mit einer Generationszeit von 1–4 Stunden. Zum Vergleich beträgt die Generationszeit von Escherichia coli in Laborkulturen unter günstigen Bedingungen 20 Minuten. Schnell wachsende Mykobakterien bilden innerhalb einer Woche makroskopisch sichtbare Kolonien, langsam wachsende benötigen hierfür bis zu 8 Wochen. Unter den langsam wachsenden Mykobakterien sind die meisten (obligaten oder fakultativen) Krankheitserreger zu finden, viele der „rapid growers“ sind apathogen. Die Unterteilung in langsam und schnell wachsende Mykobakterien ist auch phylogenetisch relevant, sie spiegelt evolutionäre Verwandtschaftsverhältnisse wider[2].
Zellwandaufbau
Eines der Hauptmerkmale von Mykobakterien ist, dass ein Großteil der Zellwandbestandteile als Antigenkomponenten wirkt. Sie rufen in Wirtsorganismen eine Immunreaktion hervor und führen zu einer Allergie vom Spättyp (Typ IV). Die bekannteste Reaktion ist die Tuberkulinreaktion.
Charakteristisch sind der hohe Lipidgehalt der Zellwand, die Mykolsäuren und speziell bei Mycobacterium tuberculosis und Mycobacterium bovis der Cord-Faktor, die Verbindungen der Mykolsäuren mit dem Disaccharid Trehalose. Durch den Cord-Faktor kommt es zu dem schnur- oder zopfartigen Wachstum in älteren Kulturen.
Die sehr hohe Säurefestigkeit (engl.: acid-fast) kommt durch die langkettigen Mykolsäuren zustande. An jeder 10ten N-Acetylmuraminsäure (welches zum Rückgrat des Peptidoglycan gehört) ist ein Arabinogalaktankomplex gebunden. Dieser besteht aus einem linearen Galaktose-Strang und ist verzweigt mit Arabinose-Ketten. An diese Komplexe sind wiederum Mykolsäuren gebunden. Die Zellwand der Mykobakterien hat demnach so etwas wie einen weiteren äußeren Bilayer.
Aufgrund dieses Zellwandaufbaus besitzen Mykobakterien eine sehr hohe Widerstandsfähigkeit. Dies bewirkt, dass die obligat parasitären Mykobakterien auch in der freien Natur unter günstigen Bedingungen mehrere Monate infektionsfähig bleiben[4] und mit wenigen Ausnahmen (z. B. Streptomycin oder Kanamycin) gegen die meisten Antibiotika resistent sind. Auch gegen die meisten Laugen und Säuren sind sie widerstandsfähiger als andere Bakterien. Die Säurefestigkeit ist durch die Ziehl-Neelsen-Färbung nachweisbar. Die Bakterienzellen lassen sich nach Einfärbung mit Anilinfarbstoffen (z. B. Karbolfuchsin) mit Säure nicht mehr entfärben. Ein Effekt, den Paul Ehrlich in Zusammenarbeit mit Robert Koch im Jahre 1882 erstmals bemerkte. Die Säurefestigkeit tritt nur bei wenigen Bakterienarten, wie Nocardia, Rhodococcus und Corynebacterium, auf.
Vorkommen
Die Mehrzahl der nichttuberkulösen Mykobakterien (MOTT) ist im Gegensatz zu dem meist auf die Wirte angewiesenen Mycobacterium tuberculosis-Komplex ubiquitär, sie leben frei in der Umwelt. Man nimmt an, dass der größte Teil der Arten saprophytisch, d.h von sich zersetzenden organischen Stoffen, lebt. Nur wenige der um 100 Arten sind als Parasiten auf den Wirt als Lebensort angewiesen. Sie wurden in Böden und Grundwasser, Staub sowie Süß- und Meerwasser nachgewiesen.[5]
Beispiele für im Boden vorkommende Mykobakterien sind der Mycobacterium terrae-Komplex (M. terrae, M. triviale und M. nonchromogenicum[5]) und M. fortuitum. Letzteres wurde auch aus Meerwasser isoliert, weitere im Meer gefundene Arten sind Mycobacterium chelonae, M. marinum und M. gordonae. Einige Arten kommen in durch menschlichen Einfluss entstandenen künstlichen Umgebungen, wie Abwasser, Klärschlamm oder Trinkwasser vor[5]. Im Trinkwasser wurden häufig Arten wie Mycobacterium gordonae, M. chelonae subsp. chelonae und M. flavescens nachgewiesen. Die im Englischen auch unter den Namen „tap water bacillus“ bekannte Art M. gordonae ist im Trinkwasser das wohl am häufigste Mykobakterium. Einige Arten, wie M. kansasii und M. avium, sind sogar in der Lage, sich in aufbereitetem (destilliertem) Trinkwasser zu vermehren und lassen sich schlecht aus infizierten Leitungswassersystemen wieder entfernen, wodurch sie auch in Krankenhäusern eine erhebliche Gefahr darstellen[5]. Im Abwasser fand man ähnliche Artenzusammensetzungen wie in Böden und Süßwasser. Wie oben schon erwähnt, können die nur in den Wirtszellen Wachstum zeigenden, obligat pathogenen Arten des Mycobacterium tuberculosis-Komplexes außerhalb des Wirtes eine Zeitlang überleben. Im Kot von Rindern soll Mycobacterium bovis bis zu 13 Tage wachstumsfähig sein[4].
Systematik und Unterteilung
Die Mykobakterien zählen zu der Ordnung Actinomycetales. Ihrer Gestalt nach sind Mykobakterien zwischen den Corynebakterien und den Proactinomyceten (Aktinomyzeten die kein dauerhaftes Mycel bilden wie z. B. Nocardia) einzuordnen, enge Verwandtschaftsverhältnisse bestehen auch zu Rhodococcus und Caseobacter (jetzt zu Corynebacterium gestellt)[2].
Die Gattung wird in drei Gruppen unterteilt:
- Der Mycobacterium tuberculosis-Komplex, die Erreger der Tuberkulose (u. a. Mycobacterium tuberculosis, M. bovis, M. microti und M. africanum)
- Mycobacterium leprae, der Erreger der Lepra
- Alle restlichen Arten werden zu den nichttuberkulösen Mykobakterien gestellt, auch als MOTT (englisch: mycobacteria other than tuberculosis) bezeichnet. Es handelt sich um frei lebende Bakterien, die nur selten krankheitserregend wirken (fakultativ pathogen).
Mycobacterium tuberculosis-Komplex
Zu dem aufgrund von rRNA-Analysen erstellten Mycobacterium tuberculosis-Komplex zählen Mycobacterium tuberculosis, M. africanum, M. bovis, M. microti und M. canettii. In den letzten Jahren wurden weiterhin die Arten M. caprae (früher als die Unterart Mycobacterium tuberculosis subsp. caprae geführt) und M. pinnipedii zu dieser Gruppe gestellt.[6] Auch der von M. bovis erzeugte Impfstamm Bacillus Calmette-Guérin (BCG) zählt zu dem Komplex.
Die Übertragung von Mycobacterium tuberculosis erfolgt durch Tröpfcheninfektion. Mycobacterium tuberculosis kann auch von Menschen auf Tiere übertragen werden. Beim Menschen sind neben den von Mycobacteriumn tuberculosis verursachten Erkrankungen nur die von M. bovis und M. africanum verursachten von nennenswerter Häufigkeit, die anderen Vertreter des Mycobacterium tuberculosis-Komplexes lösen nur sehr selten Tuberkulosen beim Menschen aus.
Der Mensch ist bei dem Komplex nur für Mycobacterium tuberculosis, M. africanum und M. canettii der primäre Hauptwirt.[7] Die anderen Bakterienarten des Komplexes sind primär für Tiere pathogen, können aber auch auf den Menschen übertragen werden und, vor allem wenn eine Immunschwäche vorliegt, humanpathogen wirken und eine Tuberkulose auslösen. Bei diesen Infektionen handelt es sich also um Zoonosen, auch eine sekundäre Übertragung von Menschen zu Tieren ist möglich. Mycobacterium africanum ist ein in Afrika häufig auftretender Tuberkuloseerreger, eventuell ist diese Art jedoch eine Variante von Mycobacterium tuberculosis. Mycobacterium bovis ist ein bei Rindern auftretender Parasit und Erreger der Rindertuberkulose, die aber auf Menschen übertragen werden kann, z. B. durch Aufnahme von nicht pasteurisierter Milch. Mycobacterium microti ist der Verursacher der Tuberkulose bei Wühlmäusen und kann von hier aus auf den Menschen als Tuberkuloseerreger übertragen werden. Mycobacterium pinnepedii ist pathogen für Robben (Robbentuberkulose) und Mycobacterium caprae für Ziegen, eine Übertragung auf den Menschen ist selten[7].
Nichttuberkulöse Mykobakterien
Die nichttuberkulösen Mykobakterien (MOTT) wirken nur selten (meist bei Menschen mit stark geschwächtem Immunsystem) krankheitserregend, sie gelten als fakultativ pathogen. Von einigen wurden bis jetzt noch keine durch sie ausgelöste Erkrankungen nachgewiesen, sie gelten als apathogen.
Den nichttuberkulösen Mykobakterien wurde erst lange Zeit nach der Beschreibung von Mycobacterium tuberculosis und M. leprae in der Medizin Beachtung geschenkt. Vor allem das in den letzten Jahren stark vermehrte Auftreten der Immunschwächekrankheit AIDS führte zu einer Häufung der durch nichttuberkulöse Mykobakterien verursachten Erkrankungen. Bei Infektionen erzeugen diese Arten zum größten Teil nicht-tuberkulöse Lungenentzündungen, Hauterkrankungen (z. B. Buruli-Ulkus durch die in den Tropen und Australien auftretende Art M. ulcerans) und Befall der Lymphknoten.
Weitere Bezeichnungen für diese Gruppe sind MOTT (mycobacteria other than tuberculosis), Nontuberculous mycobacteria (NTM) und „atypische Mykobakterien“. Da sie frei in der Umwelt vorkommen, werden sie auch als „Potentiell pathogene Umwelt (environmental) Mykobakterien“ (PPUM bzw. PPEM) bezeichnet.
Nach Runyon erfolgt die Unterteilung der nichttuberkulösen Mykobakterien nach Wachstumsgeschwindigkeit und Pigmentbildung bei Belichtung (sogenannte Photochromogenität). Das Pigmentverhalten ist allerdings phylogenetisch nicht relevant.
- Gruppe I: Photochromogene, langsam wachsende (slow growers) Mykobakterien: Sie bilden nur unter dem Einfluss von Licht gelbe Farbpigmente. Beispielarten: Mycobacterium kansasii, M. marinum, M. asiaticum und M. simiae.
- Gruppe II: Skotochromogene slow growers bilden auch im Dunklen Pigmente. Beispiele: Mycobacterium scrofulaceum, M. szulgae und M. xenopi.
- Gruppe III: Nichtchromogene slow growers bilden niemals Pigmente. Beispielarten: Mycobacterium ulcerans, der Erreger der Buruli-Ulkus und der Mycobacterium avium-Komplex (MAC), bestehend aus Mycobacterium intracellulare und Mycobacterium avium.
- Gruppe IV: Schnellwachsende Mykobakterien, die auf Agarmedien schon innerhalb einer Woche gut sichtbare Kolonien bilden, z. B. Mycobacterium fortuitum.
Der gesamte Mycobacterium tuberculosis-Komplex und Mycobacterium leprae zählen zu der Gruppe III. Apathogene, nicht krankheitserregende Mykobakterien wie M. moriokaense stammen überwiegend aus der Gruppe der schnellwachsenden, nichttuberkulösen Mykobakterien (Gruppe IV).[8]
Pathogene nichttuberkulöse Mykobakterien
Eine direkte Übertragung von Mensch zu Mensch ist in der Regel nicht möglich. Die Infektion erfolgt meist über infizierte Materialien oder aerogen (Tröpfcheninfektion). Die nichttuberkulösen Mykobakterien sind oft unempfindlich gegen Medikamente, mit denen man die Tuberkulose behandelt (Antituberkulotika) und weisen generell eine hohe Resistenz gegenüber Fremdeinflüssen auf.
Einige pathogene Arten der Gruppe I: Mycobacterium kansasii kann nicht-tuberkulöse Lungenkrankheiten hervorrufen, Humaninfektionen von Mycobacterium marinum können z. B. in Schwimmbädern erfolgen und verursachen Granulome (Schwimmbadgranulome).
Pathogene Arten der Gruppe II: Mycobacterium scrofulaceum ist ein weltweit verbreiteter Erreger der Lymphadenitis, M. szulgae
Arten der Gruppe III: Mycobacterium malmoense kann Erkrankungen der Lunge hervorrufen. Mycobacterium avium kann die Geflügeltuberkulose bei Hühner, Puten, Tauben und anderen Vögeln auslösen, selten infiziert das Bakterium auch Schweine, Rinder oder Pferde. Bei Menschen kann es Lungenerkrankungen und (bei Kindern) Lymphadenitis auslösen. Mycobacterium avium ist das am häufigsten auftretende pathogene Mykobakterium bei AIDS-Patienten. Es wird zusammen mit Mycobacterium intracellulare dem aufgrund von genetischen Untersuchungen gegründeten Mycobacterium avium-Komplex (MAC) zugeordnet. Bei dem Mycobacterium avium-intracellulare-scrofulaceum-Komplex (MAIS) wird zusätzlich die Art Mycobacterium scrofulaceum hinzugestellt. M. ulcerans ruft das Buruli-Ulkus aus, eine in den Tropen auftretende Hautkrankheit.
Pathogene Arten der Gruppe IV: Mycobacterium chelonae kann Haut- oder Weichteilerkrankungen, Abszesse und auch Knochen-, Gelenkerkrankungen hervorrufen. Wie M. fortuitum, ebenfalls zu der Gruppe IV zählend, besitzt es eine hohe Resistenz gegen Desinfektionslösungen und ist somit eine mögliche Infektionsgefahr in der Klinik bei Einsatz von Implantaten.
Arten
Der Mycobacterium tuberculosis-Komplex:
- Mycobacterium africanum Castets et al. 1969
- Mycobacterium bovis Karlson & Lessel 1970, Erreger der Tuberkulose der Rinder
- Mycobacterium microti Reed 1957
- Mycobacterium pinnipedii Cousins et al. 2003
- Mycobacterium tuberculosis (Zopf 1883) Lehmann & Neumann 1896, Erreger der Tuberkulose
- Mycobacterium canettii
Einige nichttuberkulöse Mykobakterien (MOTT):
- Mycobacterium ulcerans; Erreger des Buruli-Ulkus
- Mycobacterium xenopi Schwabacher 1959
- Mycobacterium shottsii Rhodes et al. 2003
- Mycobacterium avium-Komplex
- Mycobacterium avium Chester 1901, Erreger der Geflügeltuberkulose
- Mycobacterium avium subsp. paratuberculosis (Bergey et al. 1923) Thorel et al. 1990 (Synonym: Mycobacterium paratuberculosis Bergey et al. 1923), Erreger der chronischen Enteritis beim Rind
- Mycobacterium intracellulare (Cuttino and McCabe 1949) Runyon 1965
- Mycobacterium smegmatis (Trevisan 1889) Lehmann & Neumann 1899
- Mycobacterium kansasii Hauduroy 1955
- Mycobacterium terrae-Komplex: Die Arten dieses Komplexes gehören zu der Gruppe III (langsam wachsend, unpigmentiert) und werden mit Lungenerkrankungen in Verbindung gebracht[8].
- Mycobacterium nonchromogenicum Tsukamura 1965
- Mycobacterium terrae Wayne 1966
- Mycobacterium triviale Kubica 1970
Folgende Arten gelten als apathogen, d. h. bis jetzt wurden sie noch nicht mit Krankheiten des Menschen in Verbindung gebracht. Alle hier aufgelisteten Arten zählen zu den schnellwachsenden Mykobakterien (Gruppe IV)[8]:
- Mycobacterium brumae Luquin et al. 1993
- Mycobacterium chitae Tsukamura 1967
- Mycobacterium confluentis Kirschner et al. 1992
- Mycobacterium fallax Lévy-Frébault et al. 1983
- Mycobacterium moriokaense Tsukamura et al. 1986
Quellen
- ↑ P. J. Brennan: Mycobacterium and other actinomycetes. In: C. Ratledge, S. G. Wilkinson (Hrsg.): Microbial Lipids. Academic Press, London 1988, Bd. 1, S. 203-298.
- ↑ a b c d Sybe Hartmans, Jan de Bont, Erko Stackebrandt: The Genus Mycobacterium—Nonmedical In: The Prokaryotes, A Handbook of the Biology of Bacteria. 7 Bände, 3. Auflage, Springer-Verlag, New York u. a. O. 2006, Band 3: Archaea. Bacteria: Firmicutes, Actinomycetes. ISBN 0-387-25493-5
- ↑ a b c Jessup Shively: Inclusions in Prokaryotes, Springer-Verlag, 2006, ISBN 978-3-540-26205-3
- ↑ a b Michael Rolle, Anton Mayr (Hrsg.): Medizinische Mikrobiologie, Infektions- und Seuchenlehre. 7. Auflage. Enke Verlag, Stuttgart 1993, ISBN 3-432-84686-X
- ↑ a b c d R. Schulze-Roebbecke (1993)
- ↑ Mario C. Raviglione (Hrsg.): Reichman and Hershfield’s tuberculosis: A comprehensive, international approach, Part B, Informa Healthcare, New York [u. a.] 2006, ISBN 0-8493-9271-3
- ↑ a b Juan Carlos Palomino, Sylvia Cardoso Leão und Viviana Ritacco (2007) Online
- ↑ a b c D. Schlossberg (2006)
Literatur
- Karl Bernhard Lehmann, Rudolf Otto Neumann: Atlas und Grundriss der Bakteriologie und Lehrbuch der speciellen bakteriologischen Diagnostik. Lehmann, München 1896.
- R. Schulze-Roebbecke: Mykobakterien in der Umwelt. In: Immunität und Infektion. Band 21, Heft 5, 1993
- Martin Dworkin, Stanley Falkow, Eugene Rosenberg, Karl-Heinz Schleifer, Erko Stackebrandt (Hrsg.): The Prokaryotes, 3. Auflage, Bd. 3: Archaea. Bacteria: Firmicutes, Actinomycetes. Springer Verlag, New York 2006, ISBN 978-0-387-25493-7 (Print), ISBN 978-0-387-30743-5 (Online)
- Juan Carlos Palomino, Sylvia Cardoso Leão, Viviana Ritacco: Tuberculosis 2007. Online
- D. Schlossberg: Tuberculosis & Nontuberculous Mycobacterial Infections. 5. Auflage, McGraw-Hill Publishing Company, 2006 ISBN 0-07-143913-7
Weblinks
- Triglyceride und Wachsester in Bakterien - Westfälische Wilhelms-Universität Münster, IMMB - Arbeitskreis Prof. Dr. Alexander Steinbüchel
- J.P. Euzéby: List of Prokaryotic Names with Standing in Nomenclature – Genus Mycobacterium
Dieser Artikel befindet sich derzeit im Review-Prozess. Sag auch dort deine Meinung und hilf mit, den Artikel zu verbessern!
Wikimedia Foundation.