- NaNO2
-
Strukturformel 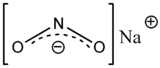
Allgemeines Name Natriumnitrit Andere Namen - salpetrigsaures Natrium
- E 250
Summenformel NaNO2 CAS-Nummer 7632-00-0 ATC-Code V03AB08
Kurzbeschreibung farblose bis leicht gelbliche Kristalle Eigenschaften Molare Masse 68,99 g·mol−1 Aggregatzustand fest
Dichte 2,17 g·cm−3[1]
Schmelzpunkt Siedepunkt ab 320 °C (Zersetzung)[1]
Löslichkeit gut in Wasser (820 g·l−1 bei 20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 


Brand-
förderndGiftig Umwelt-
gefährlich(O) (T) (N) R- und S-Sätze R: 8-25-50 S: (1/2)-45-61 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 85 mg·kg−1 (Ratte)
WGK 2[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumnitrit, NaNO2 (englisch: sodium nitrite), ist das Natriumsalz der Salpetrigen Säure HNO2.
Inhaltsverzeichnis
Eigenschaften
Natriumnitrit bildet farblose bis leicht gelbliche Kristalle, die sich in Wasser unter starker Abkühlung lösen, die Lösung reagiert alkalisch. Die Kristalle haben einen Schmelzpunkt von 280 °C und zersetzen sich ab 320 °C. Natriumnitrit ist brandfördernd (vor allem bei höheren Temperaturen) und reagiert heftig mit Aluminium (vor allem Pulver), trockenen Ammoniumverbindungen (wie beispielsweise Ammoniumsulfat), Cyaniden und vielen organischen Verbindungen. Es ist ein Reduktionsmittel und wird an der Luft langsam zu Natriumnitrat NaNO3 oxidiert.
Natriumnitrit ist giftig (tödliche Dosis etwa 4 g); im allgemeinen können Nitrite mit bestimmten Aminen bei geeigneten Bedingungen zu krebserregenden Nitrosaminen reagieren. Nitrit kann mit Eisen(II)-sulfat durch Braunfärbung nachgewiesen werden.
Vorkommen und Herstellung
In der Natur kommen Nitrite als Zwischenstufen im Stickstoffkreislauf vor – sowohl bei der Nitrifikation (Stickstoffbindung) als auch bei der Denitrifikation (Stickstoff-Freisetzung).
Technisch gewinnt man Natriumnitrit durch Einwirkung von Stickoxiden auf Natriumhydroxidlösung.
Verwendung
Unter bestimmten Auflagen ist Natriumnitrit als Lebensmittelzusatzstoff E 250 in der Funktion eines Konservierungsmittels zugelassen.[3] Im Gemisch mit Natriumchlorid verleiht Nitritpökelsalz (Natriumchlorid mit 0,4 bis 0,5 % Natriumnitrit) dem Fleisch durch Bildung von Nitrosomyoglobin eine bleibende rote Farbe und verhindert das Wachstum von Bakterien.
In der chemischen und pharmazeutischen Industrie dient es zur Synthese von Diazoniumverbindungen für Azofarbstoffe sowie Nitroso- und Isonitrosoverbindungen und als Zusatzstoff in Galvanikbädern und Rostschutzmitteln.
Zulässigkeit
Seit den 1980er-Jahren darf der Natriumnitritgehalt von Pökelsalz 0,5% nicht überschreiten und nur gemischt mit Kochsalz in den Handel gelangen.[4]
Gesundheitliche Auswirkungen
In den 1920er Jahren wurden die ersten Vergiftungen durch Pökelsalze mit Natriumnitritgehalten über 5 % berichtet.[4] In den 1970er-Jahren wurde entdeckt, dass die Nitrosamine, die aus Natriumnitrit entstehen, krebserregend sind.[4] Auch die zulässigen Beimischungen gelten als geringfügig krebserregend.
Quellen
- ↑ a b c d e Eintrag zu CAS-Nr. 7632-00-0 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 02.01.2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7632-00-0 im European chemical Substances Information System ESIS
- ↑ ZZulV Anlage 5 (zu § 5 Abs. 1 und § 7) Zusatzstoffe, die für Lebensmittel zur Konservierung oder als Antioxidationsmittel zugelassen sind
- ↑ a b c Universität Bayreuth Wurst und Chemie:Pökeln
Wikimedia Foundation.
