- Nickel(II)-nitrat
-
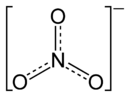
Strukturformel  _
_
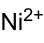
Allgemeines Name Nickel(II)-nitrat Andere Namen - Nickelnitrat
- Nickelnitrat-Hexahydrat
Summenformel Ni(NO3)2 CAS-Nummer - 13138-45-9 (wasserfrei)
- 13478-00-7 (Hexahydrat)
- 14216-75-2 (Salpetersäure, Nickelsalz)
Kurzbeschreibung grüne, zerfliessende, wasserlösliche, hygroskopische Kristalle[1]
Eigenschaften Molare Masse - 182,72 g·mol−1 (wasserfrei)
- 290,83 g·mol−1 (Hexahydrat)
Aggregatzustand fest
Dichte 2,05 g·cm−3[1]
Schmelzpunkt Siedepunkt 136,7 °C[1]
Löslichkeit sehr gut in Wasser (940 g·l−1 bei 20 °C)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 




Gefahr
H- und P-Sätze H: 272-350i-341-360D-372-332-302-318-315-317-410 EUH: keine EUH-Sätze P: 201-221-281-302+352-304+341-305+351+338-308+313 [1] EU-Gefahrstoffkennzeichnung [1] 

Giftig Brand-
fördernd(T) (O) R- und S-Sätze R: 45-8-22-43 S: 53-24-27-28-37/39-45 MAK Für krebserzeugende Stoffe wird generell kein MAK-Wert vergeben[3]
LD50 1620 mg·kg−1 (oral, Ratte)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Nickel(II)-nitrat ist eine chemische Verbindung des Metalls Nickel aus der Gruppe der Nitrate. Sie kommt gewöhnlich in Form ihres Hexahydrates Ni(NO3)2 · 6 H2O vor, weshalb sich alle Angaben aus der Tabelle auf dieses beziehen.
Inhaltsverzeichnis
Eigenschaften
Nickel(II)-nitrat ist ein starkes Oxidationsmittel und kommt in verschiedenen Hydratformen vor. Am häufigsten ist Hexahydrat (Ni(NO3)2 · 6 H2O). Beim langsamen Erhitzen des Nickel(II)-nitrat Hexahydrats bildet sich ab 45 °C das Tetrahydrat ((Ni(NO3)2 · 4 H2O)), ab 80 °C das Dihydrat (Ni(NO3)2 · 2 H2O), bei 120 bis 145 °C basisches Nickelnitrat. Beim abkühlen kann sich Nonahydrat bilden (Ni(NO3)2 · 9 H2O). Oberhalb von 200 °C beginnt sich Nickelnitrat zu Nickel(II)-oxid zu zersetzen. Beim raschen Erhitzen erfolgt zwischen 310 und 340 °C Zersetzung zu Nickel(II)-oxid, Stickoxiden und Sauerstoff.
Durch Reaktion von Nickelnitrat-Hexahydrat mit Hydrazinhydrat kann Nickelhydrazinnitrat gewonnen werden.
Durch Reaktion von Nickelnitrat mit Natriumhydroxid entsteht Nickel(II)-hydroxid.
Verwendung
Nickel(II)-nitrat verwendet man in der Keramikindustrie (als braunes Pigment), in der Färberei als Beizmittel, zum elektrolytischen Vernickeln, zum Gewinnen von Nickel(II)-oxid und zum Herstellen von reinem Katalysatornickel.
Sicherheitshinweise
Nickel(II)-nitrat wirkt brandfördernd und ist als krebserzeugend eingestuft.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 13138-45-9 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. November 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 13138-45-9 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ "Grenzwerte am Arbeitsplatz", Maximale Arbeitsplatz-Konzentrationswerte (MAK-Werte), Biologische Arbeitsstoff-Toleranzwerte (BAT-Werte) und Grenzwerte für physikalische Einwirkungen. Periodisch publiziert von SUVA.ch. PDF-Datei 2011
Kategorien:- Krebserzeugender Stoff
- Stoff mit reproduktionstoxischer Wirkung
- Gesundheitsschädlicher Stoff
- Sensibilisierender Stoff
- Brandfördernder Stoff
- Nickelverbindung
- Nitrat
Wikimedia Foundation.



