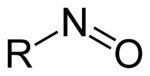
- Nitrosogruppe
-
Nitrosoverbindungen sind eine Stoffklasse organisch-chemischer Verbindungen mit der allgemeinen Strukturformel R1R2R3C-N=O. Gemeinsames Merkmal aller Nitrosoverbindungen ist die Nitrosogruppe -N=O als funktionelle Gruppe.
Nitrosoverbindungen sind nur beständig, wenn an dem Kohlenstoff, der die funktionelle NO-Gruppe trägt, kein Wasserstoff gebunden ist, also keiner der Reste R1 bis R3 = H (Wasserstoff) ist. Andernfalls lagern sie sich in die tautomeren Oxime um.
Verbindungen mit einer NO-Gruppe an einem Kohlenstoff (C-Nitroso-Verbindungen) und solche, in denen diese Gruppe an ein Stickstoffatom gebunden ist (N-Nitroso-Verbindungen), wie Nitrosamine, Nitrosamide und Nitrosoharnstoffe, unterscheiden sich in ihren chemischen und toxikologischen Eigenschaften erheblich.
C-Nitrosoverbindungen kann man in aliphatische, z. B. 2-Methyl-2-nitroso-propan, und aromatische Nitrosoverbindungen, z. B. Nitrosobenzol, unterscheiden.
Inhaltsverzeichnis
Darstellung
Aromatische Nitrosoverbindungen lassen sich durch milde Reduktion von Nitroverbindungen gewinnen.
Aliphatische Nitrosoverbindungen bilden sich bei der Addition von Nitrosylhalogeniden wie Nitrosylchlorid an Alkene.
Aktivierte Systeme lassen sich unter milden Bedingungen mit Natriumnitrit in Essigsäure nitrosylieren. Das reaktive Agens ist die dabei entstehende Salpetrige Säure. Diese Reaktion wird z. B. bei der Traubesche Synthese/Traube-Synthese von Koffein genutzt.
Sekundäre Amine reagieren mit salpetriger Säure durch Austausch des Aminowasserstoffs gegen eine Nitrosogruppe unter Wasserbildung zu der entsprechenden N-Nitrosoverbindung.
Eigenschaften und Verwendung
Nitrosoverbindungen stehen in Lösung und in Substanz mit dimeren Strukturen im Gleichgewicht. Sie können als "Spin trap" zum Nachweis von freien Radikalen dienen.
Nachweis
Der qualitative Nachweis von Nitrosoverbindungen erfolgt mit der Tollensprobe. Durch Umsetzung mit Ammoniumchlorid und Zinkstaub in Ethanol werden die Nitrosoverbindungen unter Bildung von Hydroxylamin reduziert. Dieses reagiert mit Tollens-Reagenz zu elementarem Silber.
Siehe auch
Wikimedia Foundation.