- Prostaglandin-H-Synthase
-
Cyclooxygenase-1 Oberflächenmodell nach PDB 1PRH. Unten: Substrat, Produkt Vorhandene Strukturdaten: 1cqe, 1diy, 1ebv, 1eqg, 1eqh, 1fe2, 1ht5, 1ht8, 1igx, 1igz, 1pge, 1pgf, 1pgg, 1prh, 1pth, 1q4g, 1u67, 2ayl Größe 576 Aminosäuren Struktur Homodimer Kofaktor Häm B Isoformen COX-1, COX-3 Bezeichner Gen-Namen PTGS1; COX1; COX3; PCOX1; PGG/HS; PGHS-1; PGHS1; PHS1; PTGHS Externe IDs OMIM: 176805 UniProt: P23219 MGI: 97797 CAS-Nummer: 9055-65-6 Enzymklassifikation EC, Kategorie 1.14.99.1 Dioxygenase Reaktionsart Oxidation + Peroxidation Substrat Arachidonsäure + AH2 + 2 O2 Produkte Prostaglandin H2 + A + H2O Vorkommen Homologie-Familie Prostaglandinsynthase Übergeordnetes Taxon Kiefermäuler Die Prostaglandinsynthase-1 oder Cyclooxygenase-1 (kurz: COX-1) ist ein Enzym, das Arachidonsäure zu Prostaglandin H2 in zwei Schritten oxidiert. COX-1 ist damit unverzichtbar für die Herstellung von Prostaglandin E2, das die Magensäureproduktion reguliert und überall im Körper Entzündungsreaktionen steuert, und für die Produktion von Thromboxan A2 in Thrombozyten und somit für das Aggregationsgeschehen bei der Blutgerinnung, sowie die Vasokonstriktion. Im Gegensatz zu COX-2 kommt COX-1 in allen Gewebetypen vor und seine Hemmung betrifft daher auch den ganzen Körper. Beides sind Cyclooxygenasen, welche wiederum zu der großen Familie der Pathogen-Induzierbaren-Oxygenasen (PIOXs) gehören.
Für die Hemmung des Enzyms stehen nur nichtspezifische nichtsteroidale Antirheumatika, die alle Cyclooxygenasen hemmen, zur Verfügung, wie Acetylsalicylsäure. Glücklicherweise kann Aspirin auch niedrigdosiert COX-1 in Lymphozyten blockieren, ohne beispielsweise den Magen zu schädigen. Eine Hemmung der Entzündungs-Signalwege ohne Nebenwirkung ist ansonsten nur durch spezifische COX-2-Hemmung möglich.
Inhaltsverzeichnis
Vorkommen im Organismus
Cyclooxygenasen sind im Inneren des endoplasmatischen Retikulums, innerhalb der Kernhülle und im Golgi-Apparat lokalisiert und haften der Innenseiten der Membranen dieser Zellkompartimente an.
COX-1 kommt u. a. in folgenden Zellen und Organen vor:
- In blutgerinnungsauslösenden Blutplättchen kommt ausschließlich COX-1 vor.
- COX-1 kommt in Endothelzellen normaler Blutgefäße vor (während COX-2 in den Endothelzellen proliferierender Blutgefäße, entzündeter Gewebe, und in atherosklerotischen Läsionen vorkommt).
- In der Nierenrinde und (20mal mehr im Nierenmark) kommt COX-1 vor. Dort wird vor allem Prostaglandin E2 und Prostacyclin gebildet, welches vor allem die Nierendurchblutung und damit auch die glomeruläre Filtrationsrate steigert. COX-1-hemmende NSAIDs können deshalb bei bestimmten Grundkranktheiten (Herzinsuffizienz, Leberzirrhose, Niereninsuffizienz) oder bei Überdosierung schädliche Nebenwirkungen auf die Nierenfunktion haben.
- COX-1 kommt im ganzen Gehirn, besonders aber im Frontalhirn vor; man glaubt, dass sie in die in komplexe integrative Funktionen zwischen autonomem Nervensystem und Sensorik involviert ist.
Biosynthese und Struktur
Die Cyclooxygenase-1 ist auf dem Chromosom 9q32-q33.3 kodiert. Es handelt sich (im Gegensatz zum Gen der Cyclooxygenase-2) um ein großes Gen (>28 kb) mit elf Exons, dessen Transkription ubiquitär und wohl wenig geregelt ist. Die 4.982 Basen lange mRNA wird durch Translation und posttranslationale Modifikation in das aus 576 Aminosäuren bestehende Enzym umgewandelt. Bei einer aus demselben Gen gebildeten Isoform (COX-3) fehlen 40 Aminosäuren.[1]
Wahrscheinlich vor der Zeit, in der sich die Wirbeltiere entwickelt haben, hat sich ihr Entwicklungsweg durch Genduplikation von der Cyclooxygenase-2 getrennt und ist ihren eigenen evolutionären Weg gegangen.[2] Allgemeine Strukturaspekte von COX-1 sind unter Cyclooxygenasen beschrieben.
Biologische Funktion
Katalysierte Reaktion
 + 2 O2 + AH2 --->
+ 2 O2 + AH2 --->  --->
---> 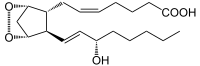 + A + H2O
+ A + H2OAndere Funktionen
COX-1 scheint Einfluss auf die Bildung neuer Blutgefäße zu haben; dies wurde an Darmkrebszellen im Labor gefunden.[3]
Pharmakologie
- Weil bei einer Hemmung der Cyclooxygenase mehr Arachidonsäure für den Lipoxygenaseweg zur Verfügung steht, was die Bildung von Leukotrienen zur Folge hat, die entzündungsverstärkend und anaphylaxieverstärkend sind, können Hemmstoffe der Cyclooxygenase einen Asthmaanfall auslösen.
- Acetylsalicylsäure (Aspirin) führt zu einer Transacetylierung am Serin in Position 530 im katalytischen Zentrum der Cyclooxygenase, die das Enzym funktionsunfähig macht, bis es wieder neu gebildet wird. Die Cyclooxygenase-1 ist hierfür 10-100 mal sensitiver als die Cyclooxygenase-2.[2]
- Kompetitiv wirkende NSAIDs konkurrieren im Cyclooxygenasezentrum um die Bindungsstelle für die Arachidonsäure. Ibuprofen bindet hierbei sehr schnell und wird auch schnell wieder ausgewaschen. Diclofenac oder Indometacin haben ein trägeres Bindungsverhalten.
Geschichtliches
Ab 1972 wurde spekuliert, dass es mehr als eine Cyclooxygenase gäbe. 1988 wurde das Genom und die primäre Proteinstruktur für die humane Cyclooxygenase-1 sequenziert. 1994 wurde die Tertiär- und Quartärstruktur bekannt. Seither werden die wesentlichen Gemeinsamkeiten und Unterschiede in Struktur, Herkunft, Vorkommen, Funktion und Regelung der beiden Cyclooxygenasen immer genauer untersucht und aufgeklärt.[2]
Einzelnachweise
- ↑ ENSEMBL-Eintrag
- ↑ a b c Simmons, D.L. et al. (2004): Cyclooxygenase isozymes: the biology of prostaglandin synthesis and inhibition. In: Pharmacol. Rev. Bd. 56, S. 387-437. PMID 15317910
- ↑ M. Tsujii et al.: Cyclooxygenase regulates angiogenesis induced by colon cancer cells. Cell 93/-/1998. S. 705-716. PMID 9630216
Weblinks
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.

