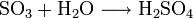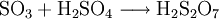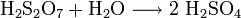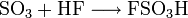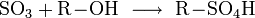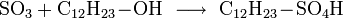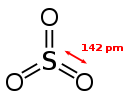- SO3
-
Strukturformel 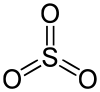
Allgemeines Name Schwefeltrioxid Andere Namen Schwefelsäureanhydrid, Acidum sulfuricum anhydricum
Summenformel SO3 CAS-Nummer 7446-11-9 PubChem 24682 Kurzbeschreibung farblose Kristalle Eigenschaften Molare Masse 80,06 g·mol−1 Aggregatzustand fest (α-, β-Form), flüssig (γ-Form)
Dichte 1,995 g·cm−3(γ-Form)[1]
Schmelzpunkt 62,2 °C (α-), 32,5 °C (β-) 16,8 °C(γ-Form), [1]
Siedepunkt 44,45 °C (β-, γ-Form), α-Form zersetzt sich bei 50 °C [1]
Dampfdruck 0,26 bar [1] (20 °C)
Löslichkeit schlecht wasserlöslich (explosionsartige Umsetzung zu Schwefelsäure), gut in konzentrierter Schwefelsäure unter Bildung von Oleum
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Ätzend (C) R- und S-Sätze R: 14-34 S: 8-25-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Schwefeltrioxid, SO3, ist das Anhydrid der Schwefelsäure. Es bildet bei Normbedingungen farblose, nadelförmige Kristalle, die äußerst hygroskopisch sind und sehr heftig mit Wasser reagieren. Es existieren für den Feststoff Schwefeltrioxid drei verschiedene Modifikationen. Einatmen hat Reizerscheinungen zur Folge, in der Lunge wird daraus Schwefelsäure, die ein lebensgefährliches Lungenödem auslösen kann.
Inhaltsverzeichnis
Gewinnung
Schwefeltrioxid wird durch Oxidation von Schwefeldioxid mit Luftsauerstoff bei 420 °C hergestellt mit Vanadiumpentoxid als Katalysator, siehe Kontaktverfahren. Reines Schwefeltrioxid erhält man durch Destillation von Oleum, das bei der Herstellung von Schwefelsäure gewonnen werden kann. Das gasförmige Schwefeltrioxid wird anschließend durch Kühlung zu flüssigem Schwefeltrioxid kondensiert. Bei Kondensation und Lagerung sind enge Temperaturgrenzen einzuhalten, da Festpunkt und Siedepunkt sehr nahe beieinander liegen.
Für kleinere Mengen kann man SO3 aus Schwefelsäure und Phosphorpentoxid oder H4P4O12 (Meta Phosphorsäure (cyclo-Phosphat)) abdestillieren.
Verwendung
Es dient hauptsächlich zur Herstellung von Schwefelsäure:
In Schwefelsäure löst sich Schwefeltrioxid schneller als in Wasser und bildet Dischwefelsäure. Mit Wasser wird diese dann zu Schwefelsäure umgesetzt:
Weiter zur Herstellung von Fluorsulfonsäure und Chlorsulfonsäure
Vermischt man Schwefeltrioxid mit Alkoholen, entstehen Alkylschwefelsäuren:
Diese Reaktion wird bei der Herstellung von Tensiden genutzt:
Die Alkylschwefelsäure wird mit Natronlauge neutralisiert und fertig ist das Fettalkoholsulfat. Weiter ist Schwefeltrioxid als Oxidationsmittel geeignet. Es wurde auch zur Herstellung von Rauchgranaten benutzt, da bereits ein Tropfen flüssiges Schwefeltrioxid einen großen Raum komplett einnebeln kann.
Eigenschaften
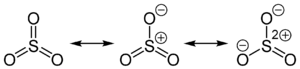
Gasförmiges Schwefeltrioxid liegt als Monomer vor. Dieses ist trigonal-planar gebaut und enthält drei gleichlange S–O-Doppelbindungen:
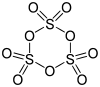
Es liegt im Gleichgewicht mit S3O9-Molekülen vor. Wird (gasförmiges) SO3 unter −80 °C abgekühlt, bildet sich das sog. γ-SO3. Dieses besteht aus S3O9-Molekülen. Es ist nicht planar aufgebaut, sondern formt einen gewellten Ring. Dabei sind die Schwefelatome von Sauerstoff verzerrt tetraedisch umgeben.
Die angegebene Strukturformel setzt sich aus wie folgt aussehenden mesomeren Grenzstrukturen zusammen:
Schwefeltrioxid verkohlt augenblicklich Gummi und die meisten Kunststoffe wie PVC, nur Teflon ist beständig, aber durch Diffusion gefährdet.
Quellen
Wikimedia Foundation.