- BG00012
-
Strukturformel 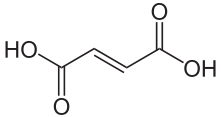
Allgemeines Name Fumarsäure Andere Namen - trans-Butendisäure
- trans-Ethylendicarbonsäure
- E 297
Summenformel C4H4O4 CAS-Nummer 110-17-8 ATC-Code D05AX01
Kurzbeschreibung weiße, fast geruchlose Kristalle[1] Eigenschaften Molare Masse 116,07 g·mol–1 Aggregatzustand fest
Dichte 1,64 g·cm–3[1]
Schmelzpunkt 287 °C[1]
Siedepunkt Sublimation: 290 °C[1]
Dampfdruck pKs-Wert - 3,0
- 4,5 [2]
Löslichkeit - löslich in Ethanol
- schlecht in Wasser: 4,9 g·l–1[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Reizend (Xi) R- und S-Sätze R: 36 S: (2)-26 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln WGK 1 (schwach wassergefährdend)[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Fumarsäure ist der Trivialname der ungesättigten Dicarbonsäure trans-Butendisäure, auch trans-Ethylendicarbonsäure genannt. Ihre Salze heißen Fumarate. Die isomere cis-Form heißt Maleinsäure.
Inhaltsverzeichnis
Eigenschaften
Fumarsäure hat unter Normaldruck keinen Schmelzpunkt, sondern sublimiert ab etwa 287 °C. Sie bildet bei Raumtemperatur weiße, fast geruchlose, brennbare Kristalle. Die Säure ist ein Reduktionsmittel, was ihren Einsatz als Konservierungsmittel begründet. Die wässrige Lösung reagiert stark sauer: 1 l Wasser mit darin gelösten 4,9 g Furmarsäure besitzt einen pH-Wert von 2,1.[1] Die zweiprotonige Säure besitzt einen pKs1 von 3,0 und einen pKs2 von 4,5. [2]
Vorkommen und Herstellung
Fumarsäure kommt in verschiedenen Pflanzen, Pilzen und Flechten vor. Ihren Namen erhielt sie vom Gewöhnlichen Erdrauch (Fumaria officinalis), der größere Mengen der Säure enthält. Synthetisch wird Fumarsäure durch Isomerisierung aus Maleinsäure hergestellt; dies geschieht durch Erhitzen auf über 150 °C, durch UV-Bestrahlung oder katalytisch in wässriger Lösung.
Sie entsteht auch in Organismen auf verschiedenen biochemischen Stoffwechselwegen:
- als Zwischenprodukt im Citratzyklus durch Oxidation der Bernsteinsäure in Gegenwart des Enzyms Succinatdehydrogenase (einer Lyase);
- im Harnstoffzyklus durch Spaltung der Argininbernsteinsäure;
- im Nukleotidstoffwechsel bei der Entstehung von Adenosinmonophosphat;
- durch hydrolytischen Abbau von Aminosäuren wie Phenylalanin, Tyrosin
- durch Desaminierung aus Asparaginsäure
Verwendung
Fumarsäure ist als Lebensmittelzusatzstoff E 297 zugelassen und dient als Säuerungsmittel. In der Synthesechemie wird es für die Polyester-Herstellung verwendet; in der Biotechnologie wird Ammoniak stereoselektiv an die Kohlenstoff-Kohlenstoff-Doppelbindung angelagert, es bildet sich enzymkatalysiert L-Asparaginsäure; viele - insbesondere aminogruppenhaltige - pharmazeutisch wirksame Substanzen werden als Salze der Fumarsäure verabreicht; in der Medizin werden Fumarsäureester zur Behandlung der Schuppenflechte eingesetzt und z. Zt. auf ihre Eignung zur Behandlung von Patienten mit multipler Sklerose untersucht[4]; in der Schweineaufzucht wird Fumarsäure als Futterzusatz für Ferkel genutzt um damit den pH-Wert im Darm aufrechtzuerhalten und colibedingten Infektionen vorzubeugen.
Historisches
Im Jahre 1937 erhielt Albert Szent-Györgyi den Medizin-Nobelpreis für seine biochemischen Arbeiten unter anderem auch zur Fumarsäure.
Weblinks
Quellen
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 110-17-8 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 03.06.2007 (JavaScript erforderlich)
- ↑ a b A. Reichert: Potentiometrische Titrationen in Theorie und Praxis
- ↑ Eintrag zu CAS-Nr. 110-17-8 im European chemical Substances Information System ESIS
- ↑ Kappos L, Gold R, Miller DH et al. Efficacy and safety of oral fumarate in patients with relapsing-remitting multiple sclerosis: a multicentre, randomised, double-blind, placebo-controlled phase IIb study. Lancet. 2008; 372:1463-72. PMID 18970976
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
