- Sulforaphan
-
Strukturformel 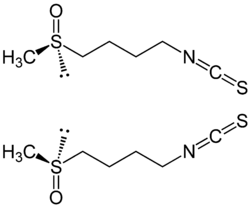
(R)-Sulforaphan (oben) und (S)-Sulforaphan (unten) Allgemeines Name Sulforaphan Andere Namen - (RS)-1-Isothiocyanato-4-methylsulfinylbutan
- (R)-1-Isothiocyanato-4-methylsulfinylbutan
- (S)-1-Isothiocyanato-4-methylsulfinylbutan
Summenformel C6H11NOS2 CAS-Nummer - 4478-93-7 [(RS)-Sulforaphan]
- 142825-10-3 [(R)-Sulforaphan]
- 155320-20-0 [(S)-Sulforaphan]
PubChem 5350 Kurzbeschreibung leicht gelbliche Flüssigkeit[1]
Eigenschaften Molare Masse 177,29 g·mol−1 Siedepunkt Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] keine GHS-Piktogramme H- und P-Sätze H: keine H-Sätze EUH: keine EUH-Sätze P: keine P-Sätze EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: 23-24/25 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Sulforaphan, chemisch 1-Isothiocyanato-4-methylsulfinyl-butan, ist ein Isothiocyanat. Das Senföl entsteht bei der enzymatischen Hydrolyse des Senfölglykosids Glucoraphanin.
Inhaltsverzeichnis
Eigenschaften und Vorkommen
Sulforaphan, ein starkes (indirektes) Antioxidans, wurde erstmals 1992 von Paul Talalay und Kollegen an der Johns-Hopkins-Universität in Baltimore isoliert und beschrieben. Der sekundäre Pflanzenstoff kommt als Senfölglykosid-Glucoraphanin insbesondere in Kreuzblütengewächsen wie Kohl und Broccoli vor. Im Unterschied zu Vitamin C, Vitamin E oder β-Carotin neutralisiert der Wirkstoff freie Radikale nicht direkt, sondern indirekt, indem es Phase-II-Enzyme aktiviert. Hierdurch werden nachhaltige antioxidative Abwehrmechanismen des Körpers in Gang gesetzt.
In verschiedenen Studien konnte sowohl in der Zellkultur als auch in Tierversuchen eine auf Tumorzellen hemmende Wirkung von Sulforaphan nachgewiesen werden. Hierbei sollen bestimmte Komponenten von sich teilenden Krebszellen, die sogenannten Mikrotubuli, von Sulforaphan zerstört werden, was zum Niedergang der Krebszelle führt.
Zudem soll der Wirkstoff keimtötend gegen den Magengeschwür-Verursacher Helicobacter pylori wirken, auch gegen Stämme, die gegen gängige Antibiotika Resistenzen gebildet haben.
Literatur
- Zhang, Y. et al. (1992): A major inducer of anticarcinogenic protective enzymes from broccoli: isolation and elucidation of structure. Proc Natl Acad Sci USA 89(6): 2399–2403; PMID 1549603; PMC 48665
- Zhang, Y. et al. (1994): Anticarcinogenic activities of sulforaphane and structurally related synthetic norbornyl isothiocyanates. Proc Natl Acad Sci USA 91(8): 3147–3150; PMID 8159717; PMC 43532
- Beecher CWW. (1994): Cancer prevention properties of varieties of Brassica oleracea: a review Am J Clin Nutr. 59(5 Suppl): 1166S–1170S; PMID 8172118; PDF (freier Volltextzugriff, auf Englisch)
- Fimognari, C. und Hrelia, P. (2007): Sulforaphane as a promising molecule for fighting cancer. Mutat Res. 635(2–3): 90–104; PMID 17134937
- Juge, N. et al. (2007): Molecular basis for chemoprevention by sulforaphane: a comprehensive review. Cell. Mol. Life. Sci. 64(9), 1105–1127. PMID 17396224
Einzelnachweise
- ↑ a b c d e Datenblatt DL-Sulforaphane bei Sigma-Aldrich, abgerufen am 29. Mai 2011.
- ↑ Jens Bitzer: Senföle, in: Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
Weblinks
Wikimedia Foundation.
