- Tetrazol
-
Strukturformel 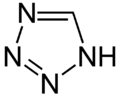
Allgemeines Name Tetrazol Andere Namen 1H-Tetrazol
Summenformel CH2N4 CAS-Nummer 288-94-8 (1H-Tetrazol) Kurzbeschreibung farblose, sublimierbare Blättchen (1H-Tetrazol) [1]
Eigenschaften Molare Masse 70,06 g·mol−1 Aggregatzustand fest
Dichte 1,406 g·cm−3[2]
Schmelzpunkt pKs-Wert 4,89[4]
Löslichkeit leicht löslich in Wasser und Ethanol, schwerlöslich in Diethylether (1H-Tetrazol) [1]
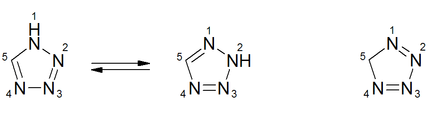
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [5] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Tetrazol ist eine heterocyclische chemische Verbindung für die drei isomere Strukturen formuliert werden können. Je nach Lage der Doppelbindungen unterscheidet man die isomeren Strukturen 1H-, 2H- und 5H-Tetrazole. 1H- und 2H-Tetrazol bilden ein Tautomeriegleichgewicht, das auf der Seite des 1H-Tetrazol (Formel in der Box) liegt. Beide Strukturen können als 6π-Heteroaromaten aufgefasst werden. 5H-Tetrazol ist eine nichtaromatische Struktur.
Inhaltsverzeichnis
Darstellung
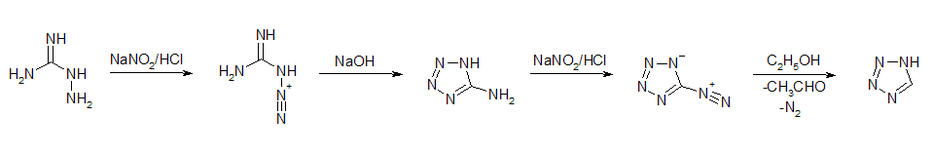
1H-Tetrazol entsteht durch Reaktion von Blausäure mit Stickstoffwasserstoffsäure.[1] Bei dieser Reaktion handelt es sich um eine 1,3-dipolare Cycloaddition. Die Verbindung kann auch durch die Deaminierung von kommerziell erhältlichem 5-Aminotetrazol, welches leicht aus Aminoguanidin hergestellt werden kann, gewonnen werden.[6][7]
Eigenschaften
1H-Tetrazol ist ein kristalliner Feststoff, der in zwei polymorphen Formen auftritt. Die beiden Kristallformen stehen enantiotrop zueinander. Unterhalb der Umwandlungstemperatur von −31 °C liegt die Form II vor. Oberhalb der Umwandlungstemperatur ist die Form I die thermodynamisch stabile Kristallform. Diese zeigt einen Schmelzpunkt bei 157 °C.[3] Die Schmelzenthalpie beträgt 18,4 kJ·mol-1[8], die Umwandlungsenthalpie am Fest-fest-Phasenübergang 14,0 J·mol-1.[3] Die Dampfdruckfunktion ergibt sich nach August entsprechend ln(P) = −A/T+B (P in Pa, T in K) mit A = 10560±168 und B = 31,148±0,458 im Temperaturbereich von 333 K bis 404 K.[3] Aus der Dampfdruckfunktion lässt sich eine molare Sublimationsenthalpie von 87,8 kJ·mol-1 ableiten.[3] Die Verbindung ist mit einer Standardbildungsenthalpie von ΔfHsolid = 236 kJ·mol−1 bzw. ΔfHgas = 320 kJ·mol−1 stark endotherm.[9][10] Die Standardverbrennungsenthalpie ΔcHsolid beträgt −915,5 kJ·mol−1.[9][10] Die wässrige Lösung von 1H-Tetrazol reagiert schwach sauer und hat etwa die gleiche Acidität wie Essigsäure.[1][4]
Bedeutung
Von den Derivaten des 1H-Tetrazols haben Tetrazoliumsalze besondere Bedeutung in der Biochemie. Die Bedeutung der Tetrazole in der Pharmazie liegt in der Bioisosterie zur Carboxygruppe. 5R,1H-Tetrazole haben ähnliche physikalische Eigenschaften wie ihre Carboxy-Analoga, zeigen aber eine höhere Stabilität gegenüber der Metabolisierung. Bekannte Pharmazeutika sind zum Beispiel das Losartan oder auch das Pentamethylentetrazol oder auch Pentetrazol, ein Analeptikum.
Sicherheit
1H-Tetrazol ist von der Bundesanstalt für Materialforschung und -prüfung (BAM) im Sinne des Sprengstoffgesetzes als explosionsgefährlicher Stoff in der Stoffgruppe A eingestuft.[11]
Einzelnachweise
- ↑ a b c d Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, Seite 1391.
- ↑ W. C. McCrone, D. Grabar, E. Lieber: Crystallographic Data. 42. Tetrazole in Anal. Chem. 23 (1951) 543, doi:10.1021/ac60051a052.
- ↑ a b c d e G. J. Kabo, A. A. Kozyro, A. P. Krasulin, V. M. Sevruk, L. S. Ivashkevich: Thermodynamic properties and tautomerism of tetrazole in J. Chem. Thermodyn. 25 (1993) 485-493, doi:10.1006/jcht.1993.1156.
- ↑ a b E. Lieber, S.H. Patinkin, H.H. Tao: The Comparative Acidic Properties of Some 5-Substituted Tetrazoles in J. Am. Chem. Soc. 73 (1951) 1792–1795, doi:10.1021/ja01148a111.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ R.A. Henry, W.G. Finnegan: An Improved Procedure for the Deamination of 5-Aminotetrazole in J. Am. Chem. Soc. 76 (1954) 290–291, doi:10.1021/ja01630a086.
- ↑ F. Kurzer, L.E.A. Godfrey: Synthesen heterocyclischer Verbindungen aus Aminoguanidin in Angew. Chem. 75 (1963) 1157–1175, doi:10.1002/ange.19630752303.
- ↑ F.R. Hilgeman, F.Y.N. Mouroux, D. Mok, M.K. Holan: Phase Diagrams of Binary Solid Azole Systems in J. Chem. Eng. Data 34 (1989) 220–222, doi:10.1021/je00056a022.
- ↑ a b A.A. Balepin, V.P. Lebedev, E.A. Miroshnichenko, G.I. Koldobskii, V.A. Ostovskii, B.P. Larionov, B.V. Gidaspov, Yu.A. Lebedev: Energy effects in polyphenylenes and phenyltetrazoles in Svoistva Veshchestv Str. Mol., 1977, 93-98.
- ↑ a b W.S. McEwan, W.S., M.W. Rigg: The heats of combustion of compounds containing the tetrazole ring in J. Am. Chem. Soc. 73 (1951) 4725-4727, doi:10.1021/ja01154a072.
- ↑ BAM-Feststellungsbescheid 301 vom 31. März 1994, pdf.
Wikimedia Foundation.