- Thiophenol
-
Strukturformel 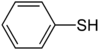
Allgemeines Name Thiophenol Andere Namen Phenylmercaptan, Benzolthiol
Summenformel C6H6S CAS-Nummer 108-98-5 PubChem 7969 Kurzbeschreibung farblose Flüssigkeit mit unangenehmem Geruch[1]
Eigenschaften Molare Masse 110,18 g·mol−1 Aggregatzustand flüssig
Dichte 1,08 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt 169 °C[1]
Dampfdruck Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 

Gefahr
H- und P-Sätze H: 226-300+310+330-315-319 EUH: keine EUH-Sätze P: 210-280-302+352-303+361+353-305+351+338-309+310 [1] EU-Gefahrstoffkennzeichnung [1] 
Sehr giftig (T+) R- und S-Sätze R: 10-24/25-26-36/38 S: 26-28-36/37-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Thiophenol ist eine organische Schwefelverbindung, eine farblose giftige Flüssigkeit mit üblem Geruch. Es ist ein wichtiger Ausgangsstoff für die organische Synthese. Thiophenole sind eine Stoffgruppe von Verbindungen, die an einem Benzolring eine Thiolgruppe (-SH) aufweisen.
Inhaltsverzeichnis
Gewinnung
Thiophenol kann unter anderem hergestellt werden durch:
- Reduktion von Benzolsulfonylchlorid mit Zink[3]
- Versetzen von Phenyl-Grignard-Verbindungen oder Phenyllithium mit Schwefel und anschließendem Ansäuern
Eigenschaften
Thiophenol hat die Formel C6H5–SH. Es liegt bei Raumtemperatur als mäßig flüchtige, aber extrem übelriechende und giftige Flüssigkeit vor. Thiophenole sind stärker sauer als Phenole, die entsprechenden Sauerstoffverbindungen.
Reaktionen
Mit Alkyliodid ergeben sich Thioether[4] Oxidation erzeugt Diphenyldisulfid, welches mit Natriumborhydrid wieder zu Thiophenol reduziert werden kann. Daher kann Thiophenol bei chemischen Reaktionen als Quelle für Wasserstoff dienen. Mit Chlor ergibt sich Phenylsulfenylchlorid.[5] Durch Reaktion von Thiophenol mit Alkalihydroxiden (Natriumhydroxid, Kaliumhydroxid) entstehen die entsprechenden Salze (Thiophenolate). Bei der Umsetzung mit Carbonsäurechloriden in Gegenwart von Basen wie Triethylamin entstehen Thiolester.[6]
Unfälle
In der Nacht auf den 16. Februar 2011 wurden aus Unachtsamkeit etwa 30 Liter Thiophenol auf dem Gelände einer Firma im nordhessischen Homberg (Efze) freigesetzt. Um die 180 Personen wurden mit den Dämpfen kontaminiert, 101 davon mussten ins Krankenhaus gebracht werden.[7][8]
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu CAS-Nr. 108-98-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2008 (JavaScript erforderlich).
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag, Leipzig 1965, S. 1411.
- ↑ Adams, R.; C. S. Marvel, C. S.: Thiophenol. Organic Syntheses, Collective Volume 1, S. 504.
- ↑ Campopiano, O.: Thiophenol. in L. Paquette (Hrsg.): Encyclopedia of Reagents for Organic Synthesis J. Wiley & Sons, New York, 2004.
- ↑ Barrett, A. G. M.; Dhanak, D.; Graboski, G. G.; Taylor, S. J.: (Phenylthio)nitromethane. Organic Syntheses, Coll. Vol. 8, p. 550 (1993).
- ↑ Gerd Buchholz, Jürgen Martens und Klaus Praefcke: 2- und 4-Azathioxanthone durch Photoumlagerung von Thionicotinsäure-S-arylestern, Angewandte Chemie 86 (1974) S. 562; Angewandte Chemie International Edition English 13 (1974) S. 550.
- ↑ faz.net vom 16. Februar 2011: Großalarm und mehr als 30 Verletzte bei Giftunfall
- ↑ nh24.de: Gefahrgutunfall: Zahl der Verletzten steigt auf 101, abgerufen am 17. Februar 2011.
Wikimedia Foundation.
