- Phenyllithium
-
Strukturformel 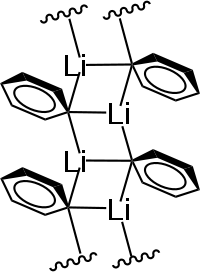
Allgemeines Name Phenyllithium Andere Namen - Lithiumphenyl
- LiPh
Summenformel C6H5Li CAS-Nummer 591-51-5 PubChem 637932 Eigenschaften Molare Masse 84,04 g·mol−1 Aggregatzustand fest
Dichte 0,835 g·cm−3[1]
Schmelzpunkt 140–143 °C[1]
Löslichkeit reagiert mit Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] Phenyllithium-Lösung in Dibutylether

Achtung
H- und P-Sätze H: 315-319-335-412 EUH: keine EUH-Sätze P: 261-273-305+351+338 [2] EU-Gefahrstoffkennzeichnung [3] 


Leicht-
entzündlichÄtzend Umwelt-
gefährlich(F) (C) (N)
Phenyllithium solution, technical, 1.8-2.1 M in cyclohexane/ether (7:3)R- und S-Sätze R: 14-17-19-22-34-50/53-65-66-67 S: 6-16-26-36/37/39-43-45-60-61-62 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Phenyllithium ist eine metallorganische Verbindung des Elements Lithium und gehört somit zu den Organolithium-Verbindungen.
Inhaltsverzeichnis
Gewinnung und Darstellung
Phenyllithium wird aus metallischem Lithium und Brombenzol oder Chlorbenzol analog den Grignard-Verbindungen dargestellt.[4]
Eine weitere Möglichkeit zur Darstellung ist die Umsetzung von Benzol mit n-Butyllithium. Als stärker CH-azide Verbindung gegenüber n-BuLi lässt sich Benzol so unter Anwesenheit von σ-Donoren (z.B. TMEDA) metallieren.[5]
TMEDA spaltet dabei das in Lösung vorliegende n-BuLi-Oligomer in Monomere und polarisiert die Li-C-Bindung, indem es diese komplexiert.
Eigenschaften
Phenyllithium kristallisiert im Festkörper in einer unendlichen, polymeren Leiterstruktur. Die Bindung des ipso-Kohlenstoffs mit den beiden Lithiumatomen in den dimeren Li2C2-Untereinheiten basiert auf einer 2-Elektronen-3-Zentren-Bindung (2e-3c). Außerdem kommt es zu einer starken Wechselwirkung der π-Elektronen der Phenylringe mit den Lithiumatomen der benachbarten Einheiten.[6][7]
In Lösung kann Phenyllithium eine Vielzahl von Strukturen ausbilden, welche vom Lösungsmittel abhängen. Bekannt sind monomere, dimere, trimere (6-gliedriger Ring), tetramere (Heterocuban) und hexamere (Oktaeder, hexagonal) Strukturen.
In THF liegt Phenyllithium als Gemisch aus Monomeren und Dimeren, in TMEDA dimer und in Diethylether dimer und tetramer vor.[8]
Verwendung
Phenyllithium wird in der organischen Chemie für eine Reihe von Synthesen (zum Beispiel bei der Bildung von Biphenylen durch nucleophile aromatische Substitutionen) eingesetzt. Es liegt dazu in technischer Form als geringprozentige Lösung (üblich etwa 20 %) in verschiedenen Lösungsmitteln wie Dibutylether, Cyclohexan/Ether vor.[9][3]
Sicherheitshinweise
Phenyllithium ist ätzend, leichtentzündlich, hochreaktiv und reagiert heftig mit Wasser.
Weblinks
- Aggregation and Reactivity of Phenyllithium Solutions; doi:10.1021/ja980684z
- Method of making Phenyllithium (Freepatentsonline)
Einzelnachweise
- ↑ a b c Datenblatt Phenyllithium bei ChemBlink, abgerufen am 25. Februar 2011.
- ↑ a b Datenblatt Phenyllithium solution bei Sigma-Aldrich, abgerufen am 19. April 2011.
- ↑ a b Datenblatt Phenyllithium bei Sigma-Aldrich, abgerufen am 23. Februar 2010.
- ↑ Gattermann und Wieland, Die Praxis des organischen Chemikers, ISBN 3-11-006654-8.
- ↑ Christoph Elschenbroich, Organometallchemie, 5.Aufl. - Teubner Verlag, 2005, S.47
- ↑ Robert E. Dinnebier, Kristallstrukturbestimmung molekularer Substanzen aus Röntgenbeugungsaufnahmen an Pulvern, Kap. 4.3 - Deutsche Gesellschaft für Kristallographie (abgerufen am 24. Juni 2011)
- ↑ Robert E. Dinnebier, Ulrich Behrens, Falk Olbrich, Lewis Base-Free Phenyllithium - J. Am. Chem. Soc., 1998, 120 (7), pp 1430–1433 (abgerufen am 24. Juni 2011)
- ↑ Hans J. Reich et al. Aggregation and Reactivity of Phenyllithium Solutions - J. Am. Chem. Soc. 1998, 120, pp 7201-7210 (abgerufen am 24. Juni 2011)
- ↑ Datenblatt Phenyllithium bei Merck, abgerufen am 23. Februar 2010.
Kategorien:- Feuergefährlicher Stoff
- Ätzender Stoff
- Umweltgefährlicher Stoff
- Gesundheitsschädlicher Stoff
- Lithiumverbindung
- Aromat
Wikimedia Foundation.


