- Titan(III)-chlorid
-
Kristallstruktur 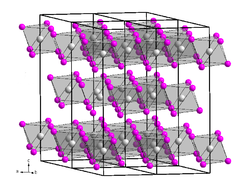
__ Ti3+ __ Cl- Allgemeines Name Titan(III)-chlorid Andere Namen Titantrichlorid
Verhältnisformel TiCl3 CAS-Nummer 7705-07-9 PubChem 62646 Kurzbeschreibung selbstentzündliche, violette Kristalle[1]
Eigenschaften Molare Masse 154,26 g·mol−1 Aggregatzustand fest
Dichte 2,64 g·cm−3[1]
Schmelzpunkt Löslichkeit zersetzt sich in Wasser mit heftiger Reaktion[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 

Gefahr
H- und P-Sätze H: 250-314 EUH: keine EUH-Sätze P: 222-231-280-305+351+338-310-422 [2] EU-Gefahrstoffkennzeichnung [1] 

Leicht-
entzündlichÄtzend (F) (C) R- und S-Sätze R: 14-17-34 S: 6-26-27-30-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Titan(III)-chlorid ist eine sauerstoffempfindliche chemische Verbindung aus der Gruppe der Chloride.
Inhaltsverzeichnis
Gewinnung und Darstellung
Titan(III)-chlorid entsteht bei der Reduktion von Titan(IV)-chlorid und bei der Reaktion von Titan mit heißer Salzsäure.
Zur Darstellung von α-Titantrichlorid wird Titantetrachlorid-Dampf gemeinsam mit viel Wasserstoff in ein auf 500 °C erhitzes Rohr geleitet, wobei sich dieses als violettes Pulver bildet.
In inerten, organischen Medien bildet Titantetrachlorid mit Aluminiumalkylen braunes, kristallines β-Titantrichlorid.
Eigenschaften
Titan(III)-chlorid kommt in vier verschiedenen Kristallstrukturen vor.
α-Titantrichlorid liegt in Bismuttriiodid-Schichtstruktur vor. Bei Temperaturen über 475 °C disproportioniert es sich in Titantetrachlorid und Titandichlorid.
β-Titantrichlorid liegt in Zirconiumtriiodid-Struktur vor. Ohne Lösemittel wandelt es sich bei über 250–300 °C, in inerten Lösemitteln bei 40–80 °C in α-Titantrichlorid um.
Wie alle Titantrihalogenide außer Titantrifluorid weist Titantrichlorid aufgrund der antiferromagnetischen Titan-Titan-Wechselwirkungen nur einen geringen Paramagnetismus auf. Die Néel-Temperatur liegt bei 180 °C.
Mit Wasser bilden sich unter Sauerstoffausschluss unbeständige Hydrate, das grüne Tetrahydrat ([Ti(H2O)4Cl2]Cl) bzw. das violette Hexahydrat ([Ti(H2O)6]Cl3).
Die Standardbildungsenthalpie
 beträgt −721 kJ/mol, die Gibbs-Energie
beträgt −721 kJ/mol, die Gibbs-Energie  beträgt −654 kJ/mol, die Standardentropie
beträgt −654 kJ/mol, die Standardentropie  140 J/(mol·K) und die Wärmekapazität
140 J/(mol·K) und die Wärmekapazität  97 J/(mol·K).[3]
97 J/(mol·K).[3]Verwendung
Titan(III)-chlorid wird als vielseitiges Reduktionsmittel, Ziegler-Natta-Katalysator und als Zusatzstoff in Bleichmitteln für Textilien verwendet.
In der Titanometrie werden Titantrichlorid-Lösungen als kräftige Reduktionsmittel zur Bestimmung von Eisen(III)-Ionen, Chromaten, Chloraten und Perchloraten verwendet.
In Prüfröhrchen wird Titantrichlorid zum Nachweis von Sauerstoff verwendet.
Sicherheitshinweise
Titan(III)-chlorid ist selbstentzündlich und wirkt ätzend. Es reagiert heftig mit Oxidationsmitteln und bei Kontakt mit Wasser.
Einzelnachweise
- ↑ a b c d e Eintrag zu CAS-Nr. 7705-07-9 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13.04.2008 (JavaScript erforderlich)
- ↑ a b Datenblatt Titanium(III) chloride bei Sigma-Aldrich, abgerufen am 24. April 2011.
- ↑ G.H. Aylward, T.J.V. Findlay: Datensammlung Chemie in SI-Einheiten. 3. Auflage. Wiley-VCH, 1999, ISBN 3-527-29468-6.
Literatur
- A.F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin/New York 1995. ISBN 3-11-012641-9.
- Autorenkollektiv: Anorganikum. 5. Auflage. VEB Deutscher Verlag der Wissenschaften Berlin 1973.
- Thieme Chemistry (Hrsg.): RÖMPP Online – Version 3.1. Georg Thieme Verlag KG, Stuttgart 2008.
TitanhalogenideOxidationsstufe (II): Titan(II)-chlorid | Titan(II)-bromid | Titan(II)-iodid
Oxidationsstufe (III): Titan(III)-fluorid | Titan(III)-chlorid | Titan(III)-bromid | Titan(III)-iodid
Oxidationsstufe (IV): Titan(IV)-fluorid | Titan(IV)-chlorid | Titan(IV)-bromid | Titan(V)-fluorid
Wikimedia Foundation.

