- Barbitursäure
-
Strukturformel 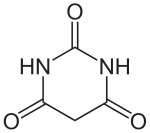
Allgemeines Name Barbitursäure Andere Namen - 2,4,6(1H,3H,5H)-Pyrimidintrion
- 2,4,6-Trihydroxypyrimidin
- 6-Hydroxyuracil
- N,N'-Malonylharnstoff
Summenformel C4H4N2O3 CAS-Nummer 67-52-7 PubChem 6211 Kurzbeschreibung farbloses, kristallines Pulver mit schwachem Geruch[1]
Eigenschaften Molare Masse 128,09 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit mäßig in Wasser (142 g·l−1 bei 20 °C)[1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Barbitursäure ist eine heterocyclische chemische Verbindung, die als Ausgangssubstanz zur Herstellung der Barbiturate und in der Analytik Verwendung findet. Die Substanz zählt zu den Derivaten des Harnstoffs, zu den Lactamen und ist gleichzeitig ein hydrierter Abkömmling des Pyrimidins.
Inhaltsverzeichnis
Geschichte
Die Konstitution der Barbitursäure wurde erstmalig von Adolf von Baeyer im Jahre 1864 bei seinen Studien über Harnsäure erkannt.[3] Er soll seine Entdeckung nach seiner Geliebten Barbara benannt haben.[4] oder, nach anderen Quellen, nach der Alchemistin Barbara von Cilli (1390–1451).[5] Baeyer fand, dass die Verbindung bei der Hydrolyse Harnstoff und Malonsäure ergab. Die Synthese aus diesen Abbauprodukten wurde 1879 von dem französischen Chemiker Grimaux realisiert, welcher diese mit Phosphoroxychlorid als "wasserentziehendem Mittel" reagieren ließ.[6]
Acidität und Tautomerie
Wie der Name sagt, reagiert die Verbindung sauer. Ihr pKa-Wert beträgt 4,01. Daher wurde früher diskutiert, ob die Formel der Barbitursäure nicht als 2,4,6-Trihydroxypyrimidin geschrieben werden sollte. Dies ist eine tautomere Form des cyclischen Harnstoff-Derivates.
Später wurde erkannt, dass die Imid-Form selbst als Säure fungieren kann: Ihr Anion (Barbiturat) ist stabilisiert durch Delokalisation der negativen Ladung.

Synthese
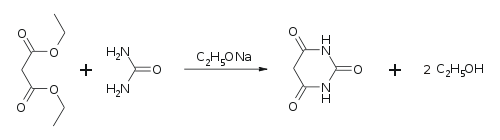
Barbitursäure kann aus Harnstoff und einem Malonsäureester, z.B. Malonsäurediethylester, in wasserfreiem Ethanol mit darin gelöstem Natriumethanolat hergestellt werden:
Verwendung
Barbitursäure ist selbst nicht sedativ-hypnotisch wirksam. Erst in Verbindung mit anderen Substituenten besitzt diese eine hypnotische Wirkung (siehe Barbiturate). Als erstes Barbiturat mit hypnotischer Wirkung wurde 1903 Diethylbarbiturat (Barbital) durch Emil Fischer und Joseph von Mering beschrieben.[7]
In der Trink- und Abwasseranalytik wird Barbitursäure als Reagenz zur kolorimetrischen Cyanidanalyse (CN−-Ion) verwendet.
Einzelnachweise
- ↑ a b c d Eintrag zu Barbitursäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Juni 2007 (JavaScript erforderlich).
- ↑ Barbitursäure bei ChemIDplus.
- ↑ Adolf Baeyer (1864): Untersuchungen über die Harnsäuregruppe. In: Justus Liebigs Annalen der Chemie. Bd. 131, Nr. 3, S. 291–302. doi:10.1002/jlac.18641310306.
- ↑ Werner Gerabek: Enzyklopädie Medizingeschichte. Walter de Gruyter, Berlin; New York 2005, ISBN 3-11-015714-4, S. 138.
- ↑ Geschichte eines Schlafmittels, Pharmazeutische Zeitung
- ↑ Grimaux, Bulletin de la Societe Chimique de France, Serie 2, 31, 146 (1879). Annales de Chimie, Serie 5, 17, 277. Zitiert nach Beilsteins Handbuch der Organischen Chemie, Band 24, S. 467
- ↑ E. Fischer & J. von Mering (1903): Über eine neue Klasse von Schlafmitteln. In: Therapie der Gegenwart. Bd. 44, S. 97–101.
Literatur
- J. R. Partington, A History of Chemistry, Band 4, 777 (1964).
- Beyer-Walter, Lehrbuch der Organischen Chemie, 21. Auflage, S. 784 , Hirzel, Stuttgart, 1988.
Weblinks
 Commons: Barbitursäure – Sammlung von Bildern, Videos und Audiodateien
Commons: Barbitursäure – Sammlung von Bildern, Videos und Audiodateien Wiktionary: Barbitursäure – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wiktionary: Barbitursäure – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wikimedia Foundation.