- Barbiturate
-
Barbiturate sind Derivate der Barbitursäure, allerdings keine Salze oder Ester, wie der Name suggeriert. Die meist aliphatischen Substituenten sind gewöhnlich am C5 der Barbitursäure zu finden. Barbitursäure wurde erstmals 1864 von Adolf von Baeyer hergestellt.[1] Barbitursäurederivate waren für viele Jahrzehnte die Schlafmittel schlechthin; das erste Barbiturat mit schlafanstoßender Wirkung (Barbital) wurde bereits 1903 von Emil Fischer synthetisiert.[2] Seit 1992 sind sie in Deutschland und der Schweiz als solche nicht mehr zugelassen und unterliegen in Deutschland – bis auf einige Ausnahmen – der Betäubungsmittel-Verschreibungsverordnung (BtMVV).
Das Barbitursäurederivat Thiopental wird bei der intravenösen Einleitung einer Vollnarkose als Alternative zu Propofol verwendet, Barbital (Handelsname Veronal) als Puffer (Veronal-Acetat-Puffer) in der Biochemie.
Inhaltsverzeichnis
Wirkmechanismus
Barbiturate haben einen komplexen Wirkmechanismus. Das heißt, sie üben ihre Wirkung über unterschiedliche Rezeptoren aus. Die entscheidende Wirkung ist der Agonismus an der β-Untereinheit des GABAA-Rezeptors. γ-Aminobuttersäure ist der bedeutendste inhibitorische, sprich hemmende Neurotransmitter im Gehirn. Während Benzodiazepine aber über die α-Untereinheit modulierend wirken (der physiologische Agonist GABA muss vorhanden sein), wirken Barbiturate direkt agonistisch (sie imitieren GABA).
Des Weiteren hemmen sie in subanästhetischer Dosis auch den exzitatorischen (erregenden) glutamatergen AMPA-Rezeptor, in noch höherer, anästhetischer Dosis auch bestimmte (tetrodotoxinempfindliche) spannungsabhängige Natriumkanäle.[3]Wirkungen
Aus der Affinität zu verschiedenen Rezeptortypen ergibt sich auch ein breites Wirkspektrum. Es wirkt dosisabhängig, von sedierend über hypnotisch (Schlaf) bis zu narkotisch. Daneben wirken sie auch antikonvolutisch (Epilepsie) und hyperalgetisch (schmerzfördernd).[4]
Nebenwirkungen
- In hypnotischer Dosierung ("Schlafmittel"):
- Morgendliches hang over, paradoxe Erregung (v.a. bei Kindern und Senioren; eine Hemmung kann in Form einer Hemmung der Hemmung auch u.U. erregend wirken), allergische Reaktion, Gefahr der Porphyrie mit akutem Anfall. Die durch Barbiturate in den ersten Nächten der Einnahme verlängerte Gesamtschlafdauer wird durch Toleranzentwicklung binnen kurzer Zeit - meist 8-10 Tagen - wieder auf den Ausgangswert und sogar darunter reduziert. Darüber hinaus von Bedeutung ist das hohe Abhängigkeitspotential mit gefährlicher Entzugssymptomatik beim Absetzen, vergleichbar dem Alkohol (Delirium tremens).
- In narkotischer Dosierung:
- Atemdepression mit dem Problem der Abnahme des Herzzeitvolumens.[5]
Eines der größten Probleme bei der Therapie mit Barbituraten ist die Tatsache, dass sie eine sehr geringe therapeutische Breite besitzen – es kann leicht überdosiert werden. Dabei besteht die Gefahr einer zentralen Atemlähmung. (Intoxikation)
Indikation
Da die meisten Präparate nicht im Handel sind, werden im Wesentlichen nur noch zwei medizinisch verwendet:
Das langwirksame (10-18h) Phenobarbital wird als Antikonvulsivum 2. und 3. Wahl in der Behandlung der Epilepsie eingesetzt.[6] [7] Es kann als funktioneller Antagonist bei konvulsiv wirkenden Substanzen wie DDT, Strychnin, Aminophenazon, Pentetrazol und Bemegrid eingesetzt werden, jedoch nicht bei der Tetanusintoxikation.Barbiturate wirken gegenüber Benzodiazepinen allerdings nicht nur schlafanstoßend, sondern schlaferzwingend, so dass sie in sehr seltenen Ausnahmesituationen im zulassungsüberschreitenden Einsatz bei ansonsten nicht beherrschbaren Schlafstörungen eingesetzt werden können.
Das kurzwirksame (10-14min) Thiopental ist als intravenöses Anästhetikum zur Narkoseeinleitung zugelassen.[8]
Einsatz außerhalb der Humanmedizin
Schnell wirksame Barbiturate werden in den USA in Kombination mit anderen Medikamenten auch zur Hinrichtung mittels Injektion verwendet.
Im Rahmen der Sterbehilfe in der Schweiz wird beispielsweise Pentobarbital von den Sterbehilfeorganisationen EXIT und Dignitas verwendet. In der Tiermedizin wird es zum Einschläfern von Tieren verwendet.Wechselwirkungen
Barbiturate induzieren bei chronischer Anwendung Cytochrom-p450-3A-Enzyme in der Leber und beschleunigen dadurch ihren eigenen Abbau – was zu vermehrter Toleranzentwicklung führt – und den Abbau einiger weiterer Medikamente und schwächt deren Wirkung ab. Dazu gehören u.a. orale Gerinnungshemmer vom Cumarin-Typ, orale Kontrazeptiva ("Anti-Baby-Pille"), verschiedene andere Antiepileptika, Glucocorticoide, u.v.m..[9]
Daneben interagieren Barbiturate natürlich mit allen anderen sedierenden und atemdepressiven Medikamenten wie Alkohol, Benzodiazepine, Opiate u.v.m..
Valproisäure und MAO-Hemmer jeglicher Art verstärken die Barbituratwirkung.[10]Intoxikation
- Akute Vergiftung:
- Zuerst stellen sich Bewusstseinsstörungen bis zum tiefen Koma ein. Die entschiedenste toxische Wirkung ist die zentrale Atemlähmung, welche mittelfristig zur Sauerstoffunterversorgung des Gehirns führt. Dies ist der limitierende Faktor beim Überleben mit Barbituratvergiftung.
- Therapie der Intoxikation:
- Als Antidot gegen die Barbiturate kommt Natriumhydrogenkarbonat in Frage. Da der limitierende Faktor die Hypoxie ist, muss vor allen Dingen auf ausreichende Sauerstoffversorgung geachtet werden. Das heißt, der Patient muss in erster Linie beatmet werden. Bei Kreislaufstillstand ist die Herz-Lungen-Wiederbelebung durchzuführen.
- Des Weiteren können verschiedene Maßnahmen getroffen werden, das Gift aus dem Körper zu bekommen: Magenspülung unter Intubationsschutz, Aktivkohle, osmotische Laxantien, forcierte Diurese, Alkalisierung des Harns, Dialyse bei voraussichtlich langer Narkose.[11]
Herstellung
Barbiturate lassen sich aus (di)substituierten Malonsäureestern durch Kondensation mit Harnstoff oder Dicyandiamid synthetisieren. Bei Verwendung von Thioharnstoff sind analog Thiobarbiturate zugänglich.[12] Technisch werden Derivate durch Knoevenagel-Reaktion aus Barbitursäure und Aldehyden dargestellt.[13]
Vertreter und Pharmakokinetik
Der zentrale sechsgliedrige Barbitursäurering ist bei den verschiedenen Derivaten jeweils am 5. Ringatom zweifach substituiert (R1 und R2). Thiobarbiturate (z. B. Thialbarbital, Thiobarbital oder Thiopental) enthalten statt des Sauerstoff-Atoms am 2. C-Atom ein Schwefelatom.
Barbiturate Name Struktur R1 R2 (Thio-)Barbiturat (O/S) Barbitursäure 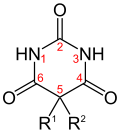
Barbiturate
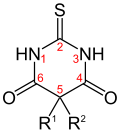
Thiobarbiturate–H –H O Allobarbital –CH2–CH=CH2 –CH2–CH=CH2 O Amobarbital –C2H5 –(CH2)2–CH(CH3)2 O Barbital –C2H5 –C2H5 O Butabarbital –C2H5 –CH(CH3)–C2H5 O Butalbital –CH2–CH=CH2 –CH2–CH(CH3)2 O Cyclobarbital –C2H5 –C6H9 (Cyclohexenyl-1) O Heptabarbital –C2H5 –C7H11 (Cycloheptenyl-1) O Pentobarbital –C2H5 –CH(CH3)–C3H7 O Phenobarbital –C2H5 –C6H5 (Phenyl) O Secobarbital –CH2–CH=CH2 –CH(CH3)–C3H7 O Thialbarbital –CH2–CH=CH2 –C6H9 (Cyclohexenyl-1) S Thiobarbital –C2H5 –C2H5 S Thiopental –C2H5 –CH(CH3)–C3H7 S Vinylbital –CH=CH2 –CH(CH3)–C3H7 O Daneben gibt es noch einige weitere Derivate, welche allesamt nicht mehr erhältlich sind.
Die Unterschiede in der chemischen Struktur wirken sich durch unterschiedlichen Grad der Lipophilie hauptsächlich auf die Pharmakokinetik aus. Die Lipophilie kann durch Einführung aromatischer Substituenten, Verlängerung der Kette oder Austausch eines Carbonyl-Sauerstoffatoms durch Schwefel verstärkt werden.
Je lipophiler das Medikament ist, desto effizienter überquert es die Blut-Hirn-Schranke, desto schneller ist sein Wirkungseintritt und desto kürzer wirkt es insgesamt, weil es sich schneller umverteilt (verschiedene Kompartimente). Ein mehr lipophiles Derivat wird mehr hepatisch metabolisiert, ein mehr hydrophiles wird eher unverändert renal ausgeschieden.[14]
Chemischer Nachweis
Barbiturate sind durch die Zwikker-Reaktion (lediglich für nicht am Stickstoff substituierte Derivate geeignet) sowie chromatographische Methoden (Dünnschicht- und Gaschromatographie), Massenspektrometrie und Radioimmunassay nachweisbar.[12]
Einzelnachweise
- ↑ Adolf Baeyer (1864): Untersuchungen über die Harnsäuregruppe. In: Justus Liebigs Annalen der Chemie. Bd. 131, Nr. 3, S. 291-302. doi:10.1002/jlac.18641310306
- ↑ E. Fischer & J. von Mering (1903): Über eine neue Klasse von Schlafmitteln. In: Therapie der Gegenwart. Bd. 44, S. 97-101.
- ↑ S. 967-970; Karow et al.; Allgemeine und spezielle Pharmakologie und Toxikologie; Aufl. 19; 2011
- ↑ S. 967-968; Karow et al.; Allgemeine und spezielle Pharmakologie und Toxikologie; Aufl. 19; 2011
- ↑ S. 967-968; Karow et al.; Allgemeine und spezielle Pharmakologie und Toxikologie; Aufl. 19; 2011
- ↑ S. 967-968; Karow et al.; Allgemeine und spezielle Pharmakologie und Toxikologie; Aufl. 19; 2011
- ↑ S. 51; Müller et al.; Neurologie und Psychiatrie für Studium und Praxis; 2011
- ↑ S. 967-968; Karow et al.; Allgemeine und spezielle Pharmakologie und Toxikologie; Aufl. 19; 2011
- ↑ siehe: http://medicine.iupui.edu/clinpharm/ddis/table.asp
- ↑ S. 967-968; Karow et al.; Allgemeine und spezielle Pharmakologie und Toxikologie; Aufl. 19; 2011
- ↑ Karow et al.: Allgemeine und spezielle Pharmakologie und Toxikologie. Aufl. 19; 2011, S. 1171.
- ↑ a b Thieme Chemistry (Hrsg.): Eintrag zu Barbiturate im Römpp Online. Version 3.14. Georg Thieme Verlag, Stuttgart 2011, abgerufen am 13. April 2011.
- ↑ Ashnagar, Alamdar; Naseri, Nahid Gharib; Sheeri, Behrang: Chinese Journal of Chemistry, Volume 25, Issue 3, Pages 382-384, 2007.
- ↑ S. 967-968; Karow et al.: Allgemeine und spezielle Pharmakologie und Toxikologie; Aufl. 19; 2011
Weblinks
 Commons: Barbiturates – Sammlung von Bildern, Videos und Audiodateien
Commons: Barbiturates – Sammlung von Bildern, Videos und Audiodateien- Barbiturate. In: Erowid. (englisch)

Bitte den Hinweis zu Gesundheitsthemen beachten! - In hypnotischer Dosierung ("Schlafmittel"):
Wikimedia Foundation.
