- Trimethylaluminium
-
Strukturformel 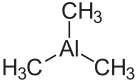
Allgemeines Name Trimethylaluminium Summenformel - C3H9Al
- C6H18Al2 (Dimer)
CAS-Nummer 75-24-1 PubChem 16682925 Kurzbeschreibung pyrophore, farblose Flüssigkeit[1]
Eigenschaften Molare Masse - 72,08 g·mol−1
- 144,18 g·mol−1 (Dimer)
Aggregatzustand flüssig
Dichte 0,75 g·cm−3[2]
Schmelzpunkt Siedepunkt 125 °C[2]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 

Gefahr
H- und P-Sätze H: 250-260-314 EUH: keine EUH-Sätze P: 222-223-231+232-280-370+378-422 [2] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Leicht-
entzündlichÄtzend (F) (C) R- und S-Sätze R: 14-17-34 S: (1/2)-16-43-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Trimethylaluminium (TMA oder TMAl) ist eine pyrophore farblose Flüssigkeit und gehört zu den Aluminiumalkylen. TMA besitzt einen Siedepunkt von 127 °C und einen sehr hohen Dampfdruck (an der Luft ist weißer Rauch sichtbar). Die Flüssigkeit geht an der Luft spontan in Flammen auf und reagiert explosionsartig mit Wasser. Darum muss diese Verbindung unter Argon oder Stickstoff gelagert und gehandhabt werden. Als Reagenz wird oft die Lösung in Toluol, Hexan oder Heptan verwendet.
Inhaltsverzeichnis
Eigenschaften
Chemische Eigenschaften
Da das Aluminiumion nur von drei Methylgruppen umgeben ist, besitzt es nur sechs Valenzelektronen. Um die Oktettregel zu erfüllen und eine Edelgaskonfiguration zu erreichen bildet sich das Dimer des TMA, in dem die beiden Aluminiumkerne durch zwei Methylgruppen verbrückt sind. Man kann dies mit dem Diboran-Molekül vergleichen, wobei die Aluminiumatome den Boratomen und die Methylgruppen den Wasserstoffatomen entsprechen. Wie die Wasserstoffkerne im Diboran bilden die verbrückenden Methylgruppen eine 2-Elektronen-3-Zentren-Bindung, wobei jede Methylgruppe jeweils zwei Elektronen zur Verfügung stellt. Obwohl die Kohlenstoffatome der verbrückenden Methylgruppen jeweils von fünf Nachbarn umgeben sind, haben sie nur acht Elektronen in der äußersten Schale. Diese Situation verursacht ein Elektronendefizit, welches TMA äußerst reaktiv macht. TMA ist eine Lewis-Säure und reagiert mit einer Vielzahl von Substanzen. Es tauscht sehr rasch Methylgruppen gegen andere Gruppen oder Atome (beispielsweise Halogene) aus, welche mehr Elektronen enthalten. Diese Eigenschaft macht TMA zu einem hervorragenden Methylierungsmittel.
Verwendung
TMA wird für die Herstellung von Methylaluminoxan (einem Cokatalysator für Ziegler-Natta-Polymerisationen), als Aktivator und Methylierungsmittel verwendet. Es findet außerdem Anwendung in der Halbleiter-Industrie. Aus TMA wird auch das Tebbe-Reagenz hergestellt, welches bei der Methylenierung von Estern und Ketonen zum Einsatz kommt. Mit Titantetrachlorid reagiert TMA zu dem Reetz-Reagenz welches in der Lage ist ein Keton in eine geminale Dimethyl-Verbindung zu überführen.[4]
Sicherheitshinweise
TMA ist stark ätzend. Die Verbindung entzündet sich an der Luft spontan und reagiert explosionsartig mit Wasser. Daher muss stets in einer trockenen Schutzgasatmosphäre gearbeitet werden.
Einzelnachweise
- ↑ a b Sicherheitsdatenblatt Strem
- ↑ a b c d e f Datenblatt Trimethylaluminum bei Sigma-Aldrich, abgerufen am 24. April 2011.
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Aluminiumalkyle“; Eintrag in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31. März 2009 (JavaScript erforderlich)
- ↑ Manfred T. Reetz, Wilhelm F. Maier: "tert-Alkylierung von Ketonen und Aldehyden", in: Angew. Chem. 1978, 90, 50; doi:10.1002/ange.19780900110.
Kategorien:- Feuergefährlicher Stoff
- Ätzender Stoff
- Metallorganische Verbindung
- Aluminiumverbindung
Wikimedia Foundation.
