- Trimethoxyphenylethylamin
-
Strukturformel 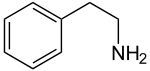
Allgemeines Name Phenethylamin Andere Namen - β-Phenylethylamin
- 2-Phenylethylamin
- 2-Phenyl-1-aminoethan
Summenformel C8H11N CAS-Nummer 64-04-0 PubChem 1001 Kurzbeschreibung fischartiger Geruch [1] Eigenschaften Molare Masse 121,18 g·mol−1 Aggregatzustand flüssig
Dichte 0,961 g·cm−3 (20 °C) [2]
Schmelzpunkt −60 °C [2]
Siedepunkt 200–202 °C [2]
Dampfdruck Löslichkeit wenig löslich in Wasser (4,3 g/l bei 20 °C), gut löslich in 2-Propanol
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Ätzend (C) R- und S-Sätze R: 22-34-52 S: 26-36/37/39-45-61 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Phenethylamin, auch β-Phenylethylamin (PEA) oder mit korrekter chemischen Bezeichnung 2-Phenylethylamin, ist als Vorläufer der Benzylisochinolin-Alkaloide in Pflanzen weit verbreitet. Phenethylamin kommt im Bittermandelöl und in Kakaobohnen vor. Es wurde auch im Gehirn und im Harn nachgewiesen. Das biogene Amin Phenethylamin als Stammsubstanz der Catecholamine und vieler Halluzinogene wird mit dem Entstehen von Lust- und Glücksempfindlungen in Verbindung gebracht.[1] Phenethylamin wird durch Monoaminoxidasen (MAO) abgebaut.[4]
Phenylethylamin ist die Stammsubstanz der Stoffgruppe der Phenylethylamine.
Inhaltsverzeichnis
Chemie
Synthese
Phenethylamin ist eine natürliche Verbindung, die durch enzymatische Decarboxylierung aus der Aminosäure Phenylalanin biosynthesiert wird. In einer weiteren möglichen Synthesevariante wird Benzaldehyd mit Nitromethan zum Nitrostyrol kondensiert. Die Hydrierung ergibt PEA.
Strukturbetrachtung
Homologe: Das nächst höhere Seitenketten-Homologe ist das Amphetamin (-β-ethyl versus -isopropyl), weitere Homologe sind bekannt. Meskalin ist ein Beispiel für ein Phenylkern-Derivat (3,4,5-Trimethoxy-substituiert).
Gleichzeitig Kern- und Seitenketten-substituiert ist das Noradrenalin. Vielfältige Derivatisierungs-Optionen eröffnen ein weites Feld von Strukturvarianten: PEA-Derivate.
Wirkung
Aufgenommenes PEA hat bei Menschen keinerlei Wirkung. Sogar in Dosen von 1600 mg oral und 50 mg intravenös zeigt sich kein Effekt.[5] Der Grund dafür mag darin liegen, dass PEA im menschlichen und tierischen Körper schnell abgebaut wird. [6]
Einzelnachweise
- ↑ a b Thieme Chemistry (Hrsg.): Römpp Online. Version 3.1. Georg Thieme Verlag, Stuttgart 2007.
- ↑ a b c d e Eintrag zu Phenethylamin in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 19. November 2007 (JavaScript erforderlich)
- ↑ Phenethylamin bei ChemIDplus
- ↑ Nagatsu, T. (2004): Progress in monoamine oxidase (MAO) research in relation to genetic engineering. In: Neurotoxicology. Bd. 25, S. 11-20. PMID 14697876
- ↑ Alexander Shulgin, PIHKAL, S.815ff
- ↑ Oxidation of beta-phenylethylamine by both types of monoamine oxidase: examination of enzymes in brain and liver mitochondria of eight species. Suzuki O; Katsumata Y; Oya M Journal of neurochemistry (1981), 36(3), 1298-301.
Literatur
- Alexander Shulgin, Ann Shulgin: PIHKAL – A Chemical Love Story. Transform Press, ISBN 0-96300-960-5
Weblinks
Wikimedia Foundation.
