- Tumornekrosefaktor-α
-
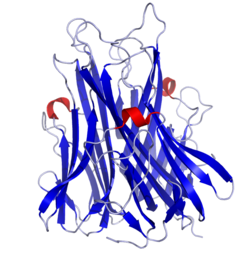
Tumornekrosefaktor Bändermodell nach PDB 1TNF Vorhandene Strukturdaten: 1a8m, 1tnf, 2az5, 2tun, 4tsv, 5tsw Größe 233/157 AS (Membran/Löslich) Struktur Homotrimer; Membranform: single pass Typ II Membranprotein Precursor 233 AS; 25,6 kDa Isoformen Lösliche Form aus Membranprotein durch Proteolyse Bezeichner Gen-Namen TNF; DIF; TNF-alpha; TNFA; TNFSF2 Externe IDs OMIM: 191160 UniProt: P01375 MGI: 104798 Vorkommen Homologie-Familie TNF Übergeordnetes Taxon Theria Tumornekrosefaktor (kurz: TNF, oder noch gebräuchlich: Tumornekrosefaktor-α kurz: TNF-α, oder veraltet: "Kachektin", oder ganz wissenschaftlich: "tumor necrosis factor ligand superfamily member 2 kurz TNFSF2) ist ein multifunktionaler Signalstoff (Zytokin) des Immunsystems, welcher bei lokalen und systemischen Entzündungen beteiligt ist. Die Multifunktionalität von Zytokinen wird häufig als Pleiotropie bezeichnet; diese Bezeichnung sollte aber in diesem Zusammenhang nicht gebraucht werden. TNF wird hauptsächlich von Makrophagen ausgeschüttet. Seine wichtigste Funktion ist, die Aktivität verschiedener Immunzellen zu regeln. TNF kann den Zelltod (Apoptose), Zellproliferation, Zelldifferenzierung und Ausschüttung anderer Zytokine anregen. Es löst Fieber aus und ist an der Entstehung der Kachexie bei bestimmten Krankheiten beteiligt. Ferner hat es Effekte auf den Fettstoffwechsel, die Koagulation, die Insulinresistenz und die endotheliale Funktion.
TNF ist zusammen mit Lymphotoxin-α (syn: TNF-β) einer der am längsten bekannten Vertreter der TNF/TNFR-Superfamilie, eines Zytokinsystems, welches wichtige Funktionen in der Immunantwort und in der Organogenese vor allem des Lymphsystems hat.[1]
Inhaltsverzeichnis
Genetik, Bildung, Proteinstruktur
Das menschliche Gen für TNF wurde 1985 sequenziert; es wird auf Chromosomenabschnitt 6p21.3 kodiert, ist ca. 3 kb lang und umfasst vier Exons. TNF wird zunächst als ein 233 Aminosäuren langes, 26kDa schweres Typ-2-transmembranöses Protein transkribiert, welches sich in stabilen Homotrimeren (Dreiergruppen) arrangiert. Von dieser membrangebundenen TNF-Vorform wird durch eine proteolytische Spaltung durch die Metalloprotease TNF-α Converting Enzym (TACE) das aktive lösliche 51kDa trimerische sTNF freigesetzt.
TNF wird hauptsächlich durch Makrophagen gebildet und freigesetzt, jedoch auch durch eine große Anzahl anderer Zellen wie Lymphozyten, Mastzellen, Endothelzellen, Herzmuskelzellen, Fibroblasten und neuronalem Gewebe. Große Mengen von sTNF werden als Antwort auf Lipopolysaccharide, andere bakterielle Produkte und Interleukin-1β freigesetzt. Die Bildung wird über Toll-like Rezeptoren und den MAP-Kinase-Weg sowie NF-κB angeregt[2].
Funktionen
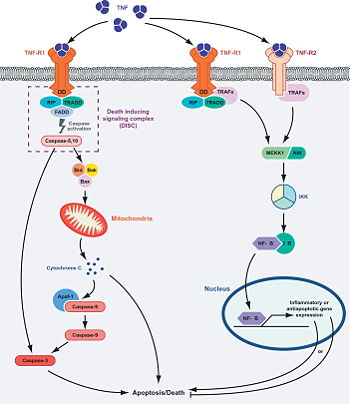
Der lösliche Tumornekrosefaktor sTNF wirkt auf zwei Rezeptoren, die er mit Lymphotoxin-α (TNF-β) teilt: 1. Den TNF-R1 und 2. den TNF-R2. Man nimmt an, dass der größte Teil der TNF-Aktivität über den TNF-R1 vermittelt wird.
Beide Rezeptoren aktivieren über den TRAF2 und verschiedene andere Zwischenschritte (siehe Bild) letztlich den nukleären Transkriptionsfaktor NF-κB, was zu Zellaktivierung, Zelldifferenzierung, Zytokinproduktion und Hemmung des programmierten Zelltodes (Apoptose) führt.
Der TNF-R1 kann auch (bei Abwesenheit von TRAF2) einen intrazellulären apoptoseinduzierenden Komplex bilden, der über die Aktivierung spezifischer Caspasen die Apoptose auslöst [3].
Die Regulation aller dieser Schritte ist äußerst komplex. Insgesamt ist TNF ein äußerst vielseitiges Zytokin mit sehr vielen Funktionen in verschiedenen Kontexten. Viele seiner Funktionen hat der TNF mit Interleukin-1β und Interleukin-6 gemeinsam. TNF bewirkt in den verschiedenen Organsystemen folgendes:
- Im Hypothalamus:
- Vermehrte Ausschüttung von CRH und darüber Stimulierung der Hypothalamus-Hypophysen-Nebennieren-Achse.
- Unterdrückung des Appetits.
- Hervorrufen aber auch Begrenzen einer Fieberreaktion (hier gibt es widersprüchliche Angaben in der Literatur).
- In der Leber: Bildung von Akute-Phase-Proteinen wie z.B. des CrP.
- In Makrophagen: Stimulierung der Phagozytose.
- Auf neutrophilen Granulozyten wirkt TNF migrationsfördernd.
- In allen Geweben: Es führt zu einer vermehrten Insulinresistenz und einer Aktivitätssteigerung der Cyclooxygenase-2.
Eine lokal erhöhte Konzentration von TNF führt zu den klassischen Entzündungssymptomen: Hitze, Schwellung, Röte und Schmerz. Hohe systemische TNF-Konzentrationen führen zu einer Schocksymptomatik.
Pharmakologie
Die Möglichkeiten Tumornekrosefaktoren therapeutisch zu verwerten sind vor allem durch die kurze Halbwertszeit dieser Stoffe beschränkt. TNF-α hemmende Medikamente werden allerdings vor allem in der Rheumatherapie eingesetzt. Wirkstoffe sind zum Beispiel Etanercept, Infliximab, Adalimumab oder Certolizumab.
Referenzen
- ↑ Hehlgans, T. und Pfeffer, K. (2005): The intriguing biology of the tumour necrosis factor/tumour necrosis factor receptor superfamily: players, rules and the games. Immunology 115:1-20.
- ↑ TOLL-like Rezeptor Signalweg auf der Kyoto Encyclopedia of Genes and Genomes (KEGG).
- ↑ a b Rahman, M.M. (2005): Modulation of Tumor Necrosis Factor by Microbial Pathogens. PLoS Pathogens 2(2):e4.
Weblinks
- Im Hypothalamus:
Wikimedia Foundation.