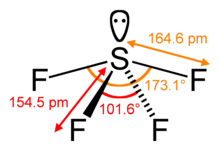
- Schwefeltetrafluorid
-
Strukturformel 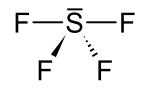
Allgemeines Name Schwefeltetrafluorid Andere Namen Schwefel(IV)-fluorid
Summenformel SF4 CAS-Nummer 7783-60-0 PubChem 24555 Kurzbeschreibung farbloses Gas mit stechendem Geruch[1]
Eigenschaften Molare Masse 108,05 g·mol−1 Aggregatzustand gasförmig
Dichte 1,919 g·cm−3 (flüssig bei −73 °C)[2]
Schmelzpunkt −121 °C[2]
Siedepunkt −40,4 °C[2]
Dampfdruck Löslichkeit Zersetzt sich in Wasser mit heftiger Reaktion[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 


Gefahr
H- und P-Sätze H: 280-314-330-335 EUH: keine EUH-Sätze P: 260-280-284-305+351+338-310-410+403 [3] EU-Gefahrstoffkennzeichnung [2] 

Sehr giftig Ätzend (T+) (C) R- und S-Sätze R: 26-35 S: (1)-9-26-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Schwefeltetrafluorid ist eine chemische Verbindung aus der Gruppe der anorganischen Schwefelverbindungen und Fluoride.
Inhaltsverzeichnis
Gewinnung und Darstellung
Schwefeltetrafluorid wird durch direkte Fluorierung von Schwefel mit Fluor hergestellt.[1] Anstelle von Fluor ist auch die Verwendung von Trichlorfluormethan möglich.[4]
Im Labor kann es auch durch Reaktion von Schwefeldichlorid mit Natriumfluorid (bzw. zusätzlich mit Chlor) hergestellt werden.[1]
Eigenschaften
Schwefeltetrafluorid ist ein farbloses, nicht brennbares Gas mit stechendem Geruch. Es zersetzt sich in Wasser mit heftiger Reaktion sowie bei Erhitzung, wobei Fluorwasserstoff entsteht. Es besitzt eine kritische Temperatur von 91 °C, der Tripelpunkt liegt bei einer Temperatur von −121 °C und einem Druck von 1,7 mbar.[2] Es wirkt als schwache Lewis-Säure und bildet zum Beispiel 1:1 Addukte mit organischen Basen wie Pyridin und Triethylamin.
Verwendung
Schwefeltetrafluorid wird als Fluorierungsmittel anorganischer Oxide, Sulfide oder Carbonyle[5] bzw. besonders der Ketogruppe C=O zu CF2 verwendet.[2]
Einzelnachweise
- ↑ a b c Georg Brauer; Handbuch der Präparativen Anorganischen Chemie, Band 1, S. 183f, ISBN 3432023286
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 7783-60-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Juni 2010 (JavaScript erforderlich).
- ↑ a b Datenblatt Sulfur tetrafluoride bei Sigma-Aldrich, abgerufen am 23. April 2011.
- ↑ D. Naumann 1, Dr. (Mrs.) D. K. Padma: Die Darstellung von Schwefeltetrafluorid aus den Elementen bei tiefer Temperatur in einem inerten Lösungsmittel. In: Zeitschrift für anorganische und allgemeine Chemie. 1973, 401, 1, S. 53–56, doi:10.1002/zaac.19734010108.
- ↑ Holleman, Wiberg: Lehrbuch der anorganischen Chemie, S.564, ISBN 978-3110126419.
Wikimedia Foundation.