- Xenondifluorid
-
Kristallstruktur 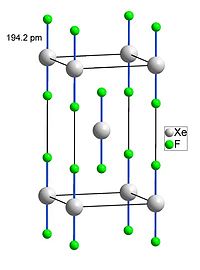
Allgemeines Name Xenondifluorid Andere Namen Xenon(II)-fluorid
Verhältnisformel XeF2 CAS-Nummer 13709-36-9 PubChem 83674 Kurzbeschreibung farblose Kristalle[1]
Eigenschaften Molare Masse 169,29 g·mol−1 Aggregatzustand fest
Dichte 4,32 g·cm−3[2]
Schmelzpunkt Dampfdruck Löslichkeit Hydrolyse in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 


Gefahr
H- und P-Sätze H: 272-301-314-330 EUH: keine EUH-Sätze P: 220-260-280-284-305+351+338-310 [3] EU-Gefahrstoffkennzeichnung [3] 

Brand-
förderndSehr giftig (O) (T+) R- und S-Sätze R: 8-25-26-34 S: 17-26-28-36/37/39-45 MAK Fluoride 2,5 mg·m−3 einatembarer Staubanteil (als Fluoride gerechnet)[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Xenon(di)fluorid (XeF2) ist eine farblose, kristalline Edelgasverbindung. Sie wurde 1962 als dritte Verbindung eines Edelgases nach Xenonhexafluoroplatinat (XePtF6)[4] und Xenontetrafluorid[5] erstmals durch Rudolf Hoppe synthetisiert[6]. Unter speziellen Bedingungen reagiert Xenon mit Fluor zu dieser Substanz. Beim raschen Erhitzen an der Luft zerfällt Xenondifluorid zu Xenon und Fluor. Trotz der negativen Bildungsenthalpie (
 ) verläuft diese Reaktion explosionsartig, da eine große Volumenzunahme stattfindet. Kristalle von Xenondifluorid haben tetragonale Symmetrie. Das Kristallgitter enthält isolierte XeF2-Moleküle; der Xenon-Fluor-Abstand beträgt 198 pm.[7].
) verläuft diese Reaktion explosionsartig, da eine große Volumenzunahme stattfindet. Kristalle von Xenondifluorid haben tetragonale Symmetrie. Das Kristallgitter enthält isolierte XeF2-Moleküle; der Xenon-Fluor-Abstand beträgt 198 pm.[7].Inhaltsverzeichnis
Darstellung
Direktsynthese aus Xenon und Fluor in der Gasphase, unter Zuhilfenahme von Katalysatoren wie Fluorwasserstoff oder Nickel(II)-fluorid sowie Bestrahlung mit UV-Licht.
Verwendung
Xenon(II)-fluorid wird als starkes Oxidations- und Fluorierungsmittel in der organischen Synthese verwendet, z.B. für die aromatische Fluorierung.[8] Eine Mischung aus Magnesium und Xenon(II)-fluorid verbrennt mit einer 2575 K heißen Flamme.[9]
Weitere Edelgasverbindungen
Zuweilen konnten noch weitere Xenonverbindungen (v. a. Chloride, Oxide), aber auch die Kryptonverbindung Kryptondifluorid (KrF2) hergestellt werden. Außerdem vermutet man, dass es, parallel zu Xenon, auch verschiedene Radonoxide und -halogenide geben muss. Die meisten Edelgasverbindungen sind im Vergleich zu Xenondifluorid wesentlich instabiler und häufig hochexplosiv. Die Reaktivität der Edelgase nimmt vermutlich mit steigendem Atomgewicht zu, sodass Radondifluorid theoretisch noch etwas stabiler als XeF2 sein müsste.
Siehe auch
Einzelnachweise
- ↑ a b Datenblatt Xenondifluorid bei Merck, abgerufen am 8. Oktober 2010.
- ↑ a b c d Datenblatt Xenondifluorid bei AlfaAesar, abgerufen am 8. Oktober 2010 (JavaScript erforderlich).
- ↑ a b c Datenblatt Xenon difluoride bei Sigma-Aldrich, abgerufen am 25. April 2011.
- ↑ N. Bartlett: Xenon Hexafluoroplatinate(V). Proceedings of the Chemical Society, 1962, S. 218 ISSN 0369-8718 doi:10.1039/PS9620000197
- ↑ H.H. Claassen, H. Selig, J.G. Malm: Xenon tetrafluoride. Journal of the American Chemical Society, 1962, S. 3593, ISSN 0002-7863
- ↑ Rudolf Hoppe, Wolfgang Dähne, H. Mattauch, K.M. Rödder: Fluorierung von Xenon. Angewandte Chemie, 1962, S. 903. ISSN 1521-3757 doi:10.1002/ange.19620742213
- ↑ H.A.Lewy, P.A.Agron: The crystal and molecular structure of xenon difluoride by neutron diffraction, Journal of the American Chemical Society, 1963, S. 241-242. ISSN 0002-7863
- ↑ M. B. Smith, J. March, March's Advanced Organic Chemistry, 5th Ed., John Wiley Sons, New York, 2001, p. 707.
- ↑ E.-C. Koch, V. Weiser, E. Roth, S. Kelzenberg, Magnesium / Xenon(II) fluoride (MAX) - A New High Energy Density Material, 35th International Pyrotechnics Seminar, July 2008, Fort Collins, USA, p. 695.
Literatur
- Melita Tramsek, Boris Zemva: Synthesis, Properties and Chemistry of Xenon(II) Fluoride. Acta Chim. Slov. 53/2/2006. S. 105–116. Online-PDF
Weblinks
- Xenon Difluoride (XeF2) beim Augustana College (Sioux Falls, South Dakota)
Wikimedia Foundation.

![\mathrm{Xe \ + \ F_2 \ \xrightarrow[UV-Licht]{Kat.} \ XeF_2 }](8/9480cb2011d5e7e86cceddd7af5f2720.png)