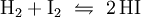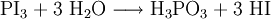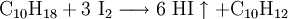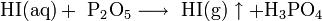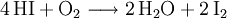- Wasserstoffiodid
-
Strukturformel 
Allgemeines Name Iodwasserstoff Andere Namen - Jodwasserstoff
- Hydrogeniodid
- Wasserstoffiodid
Summenformel HI CAS-Nummer 10034-85-2 PubChem 24841 Kurzbeschreibung farbloses Gas Eigenschaften Molare Masse 127,93 g·mol–1 Aggregatzustand gasförmig
Dichte 5,79 kg·m–3 (0 °C)[1]
Schmelzpunkt Siedepunkt −35,4 °C[1]
Dampfdruck Löslichkeit 425 g·l−1 (bei 20 °C) in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Ätzend (C) R- und S-Sätze R: 35 S: (1/2)-9-26-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Iodwasserstoff (Summenformel HI), auch als Wasserstoffiodid oder Hydrogeniodid bezeichnet, ist ein farbloses, stechend riechendes, giftiges Gas, das sich sehr gut in Wasser unter Bildung der starken Iodwasserstoffsäure löst.
Inhaltsverzeichnis
Geschichte
Die Bildungs- und Zersetzungsreaktion:
wurde bereits 1894 von dem Physiko-Chemiker Max Bodenstein eingehend und mit hoher Genauigkeit untersucht. Sie war Ende des 19. Jahrhunderts ins Blickfeld der Forscher geraten, weil sie eine Beobachtung molekularer Gleichgewichtsreaktionen ermöglichte. Neben der Knallgasreaktion und Bildung von Schwefeltrioxid bildete die Iodwasserstoffreaktion eine experimentelle Grundlage zu einer Theorie der Kinetik der Gasreaktionen.
Gewinnung und Darstellung
Industriell erfolgt die Herstellung durch katalytische Reaktion der gasförmigen Elemente über einen auf 500 °C erwärmten Platin-Schwamm als Katalysator:
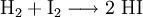
- Wasserstoff und Iod reagieren zu Iodwasserstoff.
Vereinzelt wird auch die Reaktion von Iod mit Hydrazin genutzt:
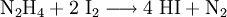
- Hydrazin und Iod reagieren zu Iodwasserstoff und Stickstoff.
Darüber hinaus vermag Wasser aus Phosphortriiodid Iodwasserstoff freizusetzen:
Diese Reaktion ist jedoch ungeeignet, um wirklich trockenen Iodwasserstoff auszutreiben.
Als Laborsynthese für Iodwasserstoff bietet sich folgende Möglichkeit an:
Des Weiteren bietet es sich im Labor an, Iodwasserstoff aus konz. Iodwasserstoffsäure zu gewinnen, obwohl dies keine Darstellung im eigentlichen Sinne darstellt.
Eigenschaften
Unter Luftabschluss ist es beständig. An Luft tritt Oxidation zu Iod ein:
Oxidationsmittel wie Brom und Chlor oxidieren Iodwasserstoff unter Bildung des entsprechenden Halogenwasserstoffes zum elementaren Iod. Beim Erhitzen spaltet sich Iodwasserstoff in die Elemente Wasserstoff und Iod auf (Rückreaktion der Bildungsreaktion).
Verwendung
Iodwasserstoff findet Verwendung zur Herstellung von Iodiden, organischen Iodverbindungen und als Katalysator. In der Analytik durch chemischen Abbau spielte er als Reduktionsmittel eine nicht unwesentliche Rolle.
Sicherheitshinweise
Iodwasserstoff reizt die Atemwege.
Quellen
- ↑ a b c d e Eintrag zu Iodwasserstoff in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 23.8.2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 10034-85-2 im European chemical Substances Information System ESIS
Halogenwasserstoffe: Fluorwasserstoff | Chlorwasserstoff | Bromwasserstoff | Iodwasserstoff | Astatwasserstoff
Halogenwasserstoffsäuren: Fluorwasserstoffsäure | Salzsäure | Bromwasserstoffsäure | Iodwasserstoffsäure
Wikimedia Foundation.