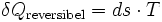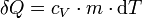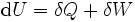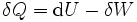- Wärmemenge
-
Wärme (auch Wärmemenge) ist eine physikalische Größe, eine Prozessgröße. Sie kann sowohl mikroskopisch durch die Kinetische Theorie, als auch makroskopisch durch die Thermodynamik beschrieben werden.
Wärme in der Thermodynamik ist über eine Systemgrenze hinweg transportierte thermische Energie. Wärme tritt als Prozessgröße nur beim Vorliegen eines Temperaturgradienten auf. Im allgemeinen Sprachgebrauch wird der Begriff Wärme häufig mit der thermischen Energie (inneren Energie = Zustandsgröße) oder auch der Temperatur verwechselt. Tritt Wärme über die Systemgrenze in einen Stoff ein, so führt dies nicht zwangsläufig zu einer Temperaturerhöhung. Die Wärme ist nach dem Übertritt auch nicht 'im Stoff enthalten', sondern führt vielmehr zu einer Zustandsänderung. Die Wärmezufuhr kann z. B. zu einer Temperaturerhöhung führen, einen Phasenübergang mit sich bringen (z. B. das Schmelzen von Eis) oder zu einer Druckänderung (bei einem Gas) führen. Die Wärme ist über die Temperatur mit der Entropie verknüpft:
Physikalische Größen
Wärme ist wie Arbeit an Transportvorgänge gebunden und daher eine Prozessgröße - im Gegensatz zu einer Zustandsgröße. Dabei wird thermische Energie aufgrund des zweiten Hauptsatzes der Thermodynamik immer vom System mit der höheren Temperatur in Richtung des Systems mit der geringeren Temperatur übertragen. Dies gilt, solange eine Temperaturdifferenz zwischen zwei thermisch gekoppelten Systemen besteht, diese sich also noch nicht im thermischen Gleichgewicht befinden.
Die übertragene Wärme Q ist meist mit einer Temperaturänderung dT verbunden:
Hierbei ist cV die spezifische Wärmekapazität bei konstantem Volumen V. Es existieren jedoch auch Systeme, bei denen eine Wärmezufuhr zur Phasenumwandlung und nicht zur Temperaturerhöhung führt, zum Beispiel beim Verdampfen von Flüssigkeiten. Auch kann die Wärmezufuhr (teilweise) in Arbeit (Symbol W) umgewandelt werden.
Als thermodynamische Größe ist die Wärme eindeutig über den ersten Hauptsatz der Thermodynamik definiert:
Wärmezufuhr erhöht also (ebenso wie Arbeitsleistung) die Innere Energie U eines Systems. Die Einzelheiten der physikalischen Vorgänge, die zum Transport von thermischer Energie führen, sind damit allerdings nicht genau festgelegt.
In der Theorie der Wärmeübertragung wird der Wärmestrom nach Jean Baptiste Joseph Fourier mit Hilfe eines Temperaturgradienten definiert.
Wärme mikroskopisch
Eine mikroskopische Deutung gibt es nur für die thermische Energie eines Materials, nicht für die Wärme, mit der sie häufig verwechselt wird. Nach dem oben Gesagten ist Wärme der Anteil der zu- oder abgeführten Energie, der eine Änderung der Inneren Energie eines Systems bewirkt, aber nicht Arbeit ist:
Eine mikroskopische Deutung der Wärme betrifft also nie ein System allein, sondern den Kontakt zwischen zwei Systemen und die daraus resultierende Wärmeübertragung.
Mikroskopisch gesehen ist thermische Energie ungerichtete Teilchenbewegung oder Vibration. Je höher die Temperatur eines Materials ist, desto schneller bewegen sich seine Atome bzw. Moleküle und umso häufiger stoßen sie in gleichen Zeiten aneinander. Die gemessene Absolute Temperatur ist direkt proportional zur kinetischen Bewegungsenergie der Teilchen. So hat z. B. ein Wasserstoffmolekül bei Raumtemperatur eine mittlere Geschwindigkeit von ~1200 m/s, das sechzehnmal schwerere Sauerstoffmolekül dagegen nur 300 m/s, wobei die kinetische Energie der beiden Teilchen übereinstimmt.
Bei sehr hohen Temperaturen (ab einigen Tausend Kelvin) nimmt die für niedrigere Temperaturen bedeutungslose, in Form von Strahlung gespeicherte Energie mehr und mehr an Bedeutung zu. So sind z. B. auf der Sonne einige Prozent der Wärme als Strahlung „zwischen den Teilchen“ gespeichert. Diese Form gewinnt erst bei so hohen Temperaturen an Bedeutung, da die elektromagnetische Abstrahlung eines Teilchens mit der vierten Potenz der Temperatur zunimmt.
Siehe auch
Wikimedia Foundation.