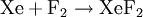- XeF2
-
Strukturformel 
Allgemeines Name Xenondifluorid Andere Namen Xenon(II)-fluorid
Summenformel XeF2 CAS-Nummer 13709-36-9 Kurzbeschreibung weißes kristallines Pulver Eigenschaften Molare Masse 169,29 g·mol−1 Aggregatzustand fest
Dichte 4,32 g·cm−3[1]
Schmelzpunkt Dampfdruck Löslichkeit 42 g/l[1] in Wasser, langsame Hydrolyse
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Giftig Brand-
fördernd(T) (O) R- und S-Sätze R: 8-23/24/25-34 S: 17-26-36/37/39-45 MAK Fluoride 2,5 mg·m−3 einatembarer Staubanteil (als Fluoride gerechnet)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Xenon(di)fluorid (XeF2) ist eine farblose, kristalline Edelgasverbindung. Sie wurde 1962 als zweite Verbindung eines Edelgases nach Xenonhexafluoroplatinat (XePtF6) erstmals durch Rudolf Hoppe synthetisiert. Unter speziellen Bedingungen reagiert Xenon mit Fluor zu dieser Substanz. Beim raschen Erhitzen an der Luft zerfällt Xenon(di)fluorid zu Xenon und Fluor. Trotz der negativen Bildungsenthalpie ( ΔfHo = − 163kJmol − 1) verläuft diese Reaktion explosionsartig, da eine große Volumenzunahme stattfindet.
Inhaltsverzeichnis
Darstellung
Direktsynthese aus Xenon und Fluor in der Gasphase, unter Zuhilfenahme von Katalysatoren wie Fluorwasserstoff oder Nickelfluorid sowie Bestrahlung mit UV-Licht.
Verwendung
Xenon(II)-fluorid wird als starkes Oxidations- und Fluorierungsmittel in der organischen Synthese verwendet, z.B. für die aromatische Fluorierung [2]. Eine Mischung aus Magnesium und Xenon(II)-fluorid verbrennt mit einer 2575 K heißen Flamme.[3].
Weitere Edelgasverbindungen
Zuweilen konnten noch weitere Xenonverbindungen (v. a. Chloride, Oxide), aber auch die Kryptonverbindung Kryptondifluorid (KrF2) hergestellt werden. Außerdem vermutet man, dass es, parallel zu Xenon, auch verschiedene Krypton- und Radonoxide und weitere zweiwertige -halogenide geben muss. Viele Edelgasverbindungen sind vermutlich hochexplosiv. Die Reaktivität der Edelgase selbst ist sehr gering, nimmt aber vom Helium zum Radon leicht zu.
Quellen
- ↑ a b c d e f Sicherheitsdatenblatt (alfa-aesar)
- ↑ M. B. Smith, J. March, March's Advanced Organic Chemistry, 5th Ed., John Wiley Sons, New York, 2001, p. 707.
- ↑ E.-C. Koch, V. Weiser, E. Roth, S. Kelzenberg, Magnesium / Xenon(II) fluoride (MAX) - A New High Energy Density Material, 35th International Pyrotechnics Seminar, July 2008, Fort Collins, USA, p. 695.
Literatur
- Melita Tramsek, Boris Zemva: Synthesis, Properties and Chemistry of Xenon(II) Fluoride. Acta Chim. Slov. 53/2/2006. S. 105–116. Online-PDF
Wikimedia Foundation.