- Ruthenium(VIII)-oxid
-
Strukturformel 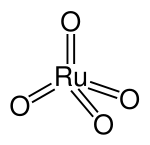
Allgemeines Name Ruthenium(VIII)-oxid Andere Namen Rutheniumtetroxid
Summenformel RuO4 CAS-Nummer 20427-56-9 PubChem 119079 Kurzbeschreibung gelber Feststoff[1]
Eigenschaften Molare Masse 165,07 g·mol−1 Dichte 3,29 g·cm−3 (20 °C)[2]
Schmelzpunkt Siedepunkt 40 °C (Zersetzung)[1]
Löslichkeit - wenig löslich in Wasser (20 g·l−1 bei 25 °C)[1]
- gut löslich in Tetrachlorkohlenstoff oder Cyclohexan[3]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [4] keine Einstufung verfügbar H- und P-Sätze H: siehe oben EUH: siehe oben P: siehe oben EU-Gefahrstoffkennzeichnung [2] 

Brand-
förderndReizend (O) (Xi) R- und S-Sätze R: 8-36/38 S: 7/8-26-28-37/39 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ruthenium(VIII)-oxid oder Rutheniumtetroxid ist eine chemische Verbindung des Rutheniums und das Oxid mit der höchsten Oxidationsstufe des Elements. Es handelt sich um einen gelben, leichtflüchtigen Feststoff, der ein starkes Oxidationsmittel ist und mit organischen Verbindungen explosiv reagiert.
Inhaltsverzeichnis
Geschichte
Ruthenium(VIII)-oxid wurde erstmals 1860 von Karl Ernst Claus isoliert. Dieser gilt auch als Entdecker des Rutheniums.[3]
Gewinnung und Darstellung
Rutheniumtetroxid lässt sich durch Oxidation von wässrigen Lösungen von Ruthenium(III)-chlorid oder Ruthenaten mit Natriumperiodat, Natriumhypochlorit oder Natriumbromat gewinnen.[3] Durch die schlechte Löslichkeit in Wasser entweicht es gasförmig aus der Lösung und lässt sich dann in geeigneten Lösungsmitteln auffangen.[5]
Eigenschaften
In Ruthenium(VIII)-oxid erreicht das Ruthenium seine maximale Oxidationsstufe +8. Es ist damit neben Osmiumtetroxid, Xenon(VIII)-oxid und einigen ähnlichen Verbindungen die einzige bekannte Verbindung, in der ein Element diese höchste bekannte Oxidationsstufe erreicht.
Das Ruthenium(VIII)-oxid-Molekül ist tetraedrisch gebaut und besitzt einen Ru-O-Abstand von 170,5 pm.[6] Es kristallisiert in Form von gelben, rhombischen Nadeln[7] und hat einen typischen nach Ozon erinnernden Geruch[6].
Rutheniumtetroxid ist thermisch instabil und zersetzt sich beim Erhitzen in Ruthenium(IV)-oxid und Sauerstoff. Es ist instabiler als das entsprechende Osmiumanalogon. Auch durch Kalilauge wird Rutheniumtetroxid reduziert, es bilden sich sechswertige Ruthenate.[6] Explosiv reagiert die Verbindung mit Ammoniak, Ethanol, oxidierbaren organischen Verbindungen, Schwefel und Iodwasserstoff.[2]
Verwendung
Ruthenium(VIII)-oxid wird in der organischen Chemie als Oxidationsmittel genutzt. Beispiele sind die Djerassi-Rylander-Oxidation, bei der Alkene in Carbonylverbindungen gespalten werden, die Oxidation von Alkoholen zu Aldehyden, Ketonen oder Carbonsäuren oder von Alkinen zu 1,2-Diketonen. Häufig wird es in situ während der Reaktion erzeugt.[7]
Bei der Trennung der Platinmetalle und Gewinnung von elementarem Ruthenium ist Ruthenium(VIII)-oxid ein wichtiges Zwischenprodukt. Durch die Bildung dieser Verbindung kann Ruthenium von den anderen Platinmetallen abgetrennt werden.[5]
Sicherheitshinweise
Ruthenium(VIII)-oxid ist brandfördernd. Bei Kontakt mit oxidierbaren Stoffen (wie zum Beispiel organischen Materialien) besteht sogar schon bei Raumtemperatur Explosionsgefahr.[2]
Einzelnachweise
- ↑ a b c d David R. Lide: CRC Handbook of Chemistry and Physics. 90. Auflage, 2009, Taylor & Francis, ISBN 978-1-4200-9084-0, Kap. 4, S. 86.
- ↑ a b c d Eintrag zu Ruthenium(VIII)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. April 2010 (JavaScript erforderlich).
- ↑ a b c W. P. Griffith: Ruthenium and Osmium Oxo Complexes as Organic Oxidants. In: Platinum Metals Review. 1989, 33, 4, S. 181–185 (pdf).
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Hermann Renner et al.: Platinum Group Metals and Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2001, doi:10.1002/14356007.a21_075.
- ↑ a b c Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1672–1673.
- ↑ a b Helmut Sitzmann: Ruthenium-Verbindungen. In: Römpp Chemie Lexikon. Thieme Verlag, Stand April 2009.
Kategorien:- Brandfördernder Stoff
- Reizender Stoff
- Rutheniumverbindung
- Oxid
Wikimedia Foundation.
