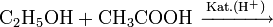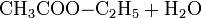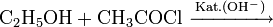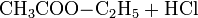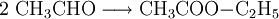- Äthylacetat
-
Strukturformel 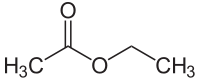
Allgemeines Name Ethylacetat Andere Namen - Ethylethanoat (IUPAC)
- Ethansäureethylester
- Essigsäureethylester
- Essigester
- ESTP
Summenformel C4H8O2 CAS-Nummer 141-78-6 PubChem 8857 Kurzbeschreibung farblose Flüssigkeit Eigenschaften Molare Masse 88,11 g·mol−1 Aggregatzustand flüssig
Dichte 0,90 g·cm−3 [1]
Schmelzpunkt Siedepunkt 77 °C[1]
Dampfdruck Löslichkeit gut in Alkohol, Aceton und Ether; wenig löslich in Wasser: 86 g·l−1 (20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Leicht-
entzündlichReizend (F) (Xi) R- und S-Sätze R: 11-36-66-67 S: (2)-16-26-33 MAK 1500 mg·m−3[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ethylacetat (UN-Nummer: 1173) ist ein charakteristisch „nach Klebstoff“ riechendes Lösungsmittel, das in der chemischen Industrie und in Laboratorien oft verwendet wird. Ethylacetat, eine farblose Flüssigkeit, ist der Carbonsäureester aus Essigsäure und Ethanol, daher wird er auch Essigsäureethylester oder kurz Essigester (EE) genannt. Ein veralteter Name ist Essigäther.
Inhaltsverzeichnis
Herstellung
Eine der großtechnischen Herstellungsverfahren der chemischen Industrie beruht auf der säurekatalysierten Veresterung von Ethanol mit Essigsäure oder besser mit der Schotten-Baumann-Methode unter Umsetzung mit Essigsäurechlorid:
Diese Gleichgewichtsreaktion wird nach dem Prinzip von Le Chatelier (Massenwirkungsgesetz) durch fortlaufende Abtrennung des entstehenden Wassers oder kontinuierliches Abziehen des Esters auf die Seite der Produkte verlagert.
Steht Acetaldehyd ausreichend zur Verfügung, kann Ethylacetat mit Aluminiumalkoholat als Katalysator nach Claisen-Tiščenko aus diesem Vorprodukt hergestellt werden:
Chemische Eigenschaften
Der Brechungsindex von Ethylacetat beträgt 1,370 (bei 20 °C), der Flammpunkt liegt bei −4 °C. In 100 ml Wasser lösen sich ca. 8 ml Ethylacetat bei 20 °C. Es bildet mit Wasser und vielen organischen Lösungsmitteln azeotrope Gemische. Das Azeotrop mit Wasser enthält 8,2 % Wasser und siedet bei 70,4 °C.
Verwendung
Ethylacetat ist ein vielseitig einsetzbares Lösemittel. Ethylacetat wird zur Extraktion von Antibiotika und zur Aromatisierung von Limonaden, Bonbons und Arzneimitteln verwendet. In Rum und einigen anderen Spirituosen ist es von Natur aus in geringen Mengen vorhanden. Auch im Wein kommt es in geringen Mengen vor, besonders wenn die Trauben durch Hagel oder Fäulnis geschädigt wurden; es verursacht dann einen Lösungsmittelton im Wein.
In Klebstoffen ist es eines der am häufigsten eingesetzten Lösungsmittel. In hoher Konzentration ist es ein Suchtgift, welches von sogenannten „Schnüfflern“ verwendet wird, um sich zu berauschen. Dies kann schwere Hirnschäden verursachen.
Aufgrund seiner starken Lösungskraft findet Ethylacetat auch als Bestandteil von Nagellackentfernern Verwendung.
In der Entomologie ist es das am häufigsten eingesetzte Tötungsmittel bei der Präparation von Insekten.
Quellen
- ↑ a b c d e f Eintrag zu Ethylacetat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 28.4.2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 141-78-6 im European chemical Substances Information System ESIS
Wikimedia Foundation.