- Benzilsäure-Umlagerung
-
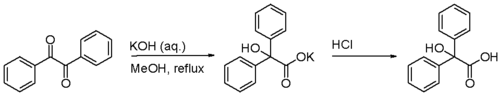
Die Benzilsäure-Umlagerung ist eine Umlagerungsreaktion von 1,2-Diketonen zu 1-Hydroxycarbonsäuren in Gegenwart starker Basen wie Kaliumhydroxid. Sie ist eng verwandt mit der Cannizzaro-Reaktion und der Benzidin-Umlagerung und wurde zuerst 1838 von Justus Liebig angewandt.[1]
Inhaltsverzeichnis
Reaktion
Die Benzilsäure als Namensgeber der Reaktion entsteht durch eine Benzilsäure-Umlagerung aus Benzil (Dibenzoyl).
Diese Diketon-Reaktion ähnelt anderen Umlagerungen: das entsprechende Ketoaldehyd (eine Alkylgruppe wird durch Wasserstoff ersetzt) lagert sich in einer Cannizzaro-Reaktion um, das 1,2-Diol reagiert entsprechend der Pinakol-Umlagerung.
Reaktionsmechanismus
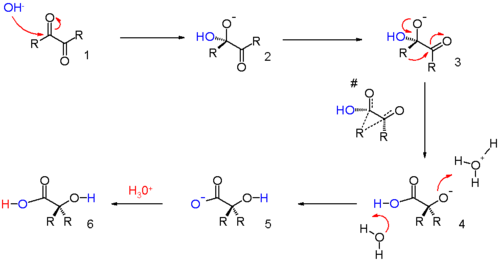
Die folgende Reaktion ist typisch für 1,2-Umlagerungen. Normalerweise sind an dieser Umlagerung Carbokationen beteiligt, hier aber kommen Carbanionen zu Reaktion. Dieser schon lange bekannte Reaktionsmechanismus wurde durch in silico-Untersuchungen bestätigt[2] und wird im folgenden ausgeführt. Ein Hydroxidanion greift eines der Ketogruppen in einer nucleophilen Addition 1 an und bildet ein Hydroxidanion 2. Im nächsten Schritt erfolgt eine Rotation um die zentrale C-C-Achse, um das konformere 3 zu erhalten. Die Reste R stehen cis-ständig zueinander. Dies ist nötig, damit der wandernde Rest in einer konzertierten Reaktion die zweite Carbonylgruppe angreifen kann und die entstehende Hydroxygruppe zur ersten Carbonylgruppe revertieren kann. Dieser Schritt ähnelt einer nucleophilen Acyl-Substitution.
Die Carbonsäure in Zwischenschritt 4 ist weniger basisch als das Hydroxidanion. Deswegen wandert das Proton zur Zwischenstufe 5, diese wiederum kann durch Säure protoniert werden und es bildet sich das Endprodukt α-Hydroxycarbonsäure 6.
Bei cyclischen 1,2-Diketonen kommt es zur Ringspannung.
Die Benzilsäure als Namensgeber der Reaktion entsteht durch eine Benzilsäure-Umlagerung aus Benzil (Dibenzoyl).
Varianten
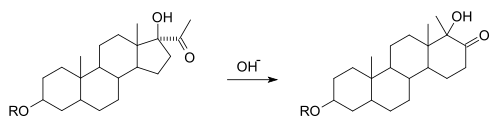
Eine Variante der Umlagerung tritt bei der Synthese verschiedener Steroide auf. In der D-Homo-Umlagerung von Steroiden wird ein Cyclopentanring unter Baseneinwirkung zum Cyclohexanring erweitert.[3][4]
Literatur
Donald A. Ballard and William M. Dehn (1941): Benzilic acid. Org. Synth.; Coll. Vol. 1: 89
Weblinks
- Laboranweisung I (PDF-Datei; 472 kB)
- Laboranweisung II
- Laboranweisung III
Einzelnachweise
- ↑ Liebig, J.: Ueber Laurent's Theorie der organischen Verbindungen. In: Annalen der Chemie. 25, 1838, S. 1–31. doi:10.1002/jlac.18380250102.
- ↑ Shinichi Yamabe, Noriko Tsuchida, and Shoko Yamazaki: A FMO-Controlled Reaction Path in the Benzil-Benzilic Acid Rearrangement. In: J. Org. Chem.. 71, Nr. 5, 2006, S. 1777–1783. doi:10.1021/jo051862r.
- ↑ L. Ruzicka, H. F. Meldahl: Über Steroide und Sexualhormone. 48. Mitteilung. Die Überführung von 17-Äthinyl-androsten-Derivaten in Pregnenon-Derivate. Herstellung des 17-Oxy-progesterons Helvetica Chimica Acta 21 (1938) 1760-1770, doi:10.1002/hlca.193802101214.
- ↑ L. Ruzicka, H. F. Meldahl: Über Steroide und Sexualhormone. (51. Mitteilung). Die Herstellung von Neo-pregnenolon aus 5-3, 17-Dioxypregnenon-(20) Helvetica Chimica Acta 22 (1939) 421-424, doi:10.1002/hlca.19390220155.
Wikimedia Foundation.