- Burgess-Reagenz
-
Strukturformel 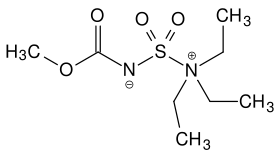
Allgemeines Name Burgess-Reagenz Andere Namen Methyl-N-(triethylammoniumsulfonyl)carbamat, inneres Salz
Summenformel C8H18N2O4S CAS-Nummer 29684-56-8 PubChem 9566069 Kurzbeschreibung farblose, nadelförmige Kristalle[1]
Eigenschaften Molare Masse 238,30 g·mol–1 Aggregatzustand fest
Schmelzpunkt Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 
Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [2] EU-Gefahrstoffkennzeichnung [3] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Das Burgess-Reagenz (IUPAC-Name: (Methoxycarbonylsulfamoyl)triethylammoniumhydroxid) ist ein sehr mildes und syn-selektives Dehydratisierungsreagenz.
Gewinnung und Darstellung
Das hier beschriebene Methylderivat, das heute unter der Bezeichnung Burgess-Reagenz auch kommerziell erhältlich ist, wurde erstmals 1970 von Crabbé und Léon[4] hergestellt. Die Synthese erfolgte allerdings nach einer Arbeitsvorschrift, die bereits 1968 von Burgess für das Ethylderivat veröffentlicht wurde.[5] Das hier beschriebene Reagenz wird aus Chlorsulfonylisocyanat mit Methanol und Triethylamin in Benzol hergestellt. Für das Ethylderivat wird nach analogem Verfahren mit Ethanol anstelle von Methanol gearbeitet.
Verwendung
Das Burgess-Reagenz eignet sich zur Synthese von Alkenen aus Alkoholen.[1][6][7][8][9] Es dient darüber hinaus auch zum Aufbau von Heterocyclen.[1]
Einzelnachweise
- ↑ a b c d Khapli, S.; Dey, S.; Mal, D. "Burgess reagent in organic synthesis." J. Indian Inst. Sci. 2001, 81, 461–476 Online-Artikel.
- ↑ a b Datenblatt Burgess-Reagenz bei Sigma-Aldrich, abgerufen am 14. März 2011.
- ↑ Datenblatt Burgess-Reagenz bei AlfaAesar, abgerufen am 17. März 2010 (JavaScript erforderlich).
- ↑ Crabbé, P.; Léon, C. "A Novel Dehydration Reaction of Steroidal Alcohols" J. Org. Chem. 1970, 35, 2594–2596.
- ↑ Atkins, G. M.; Burgess, E. M. "The Reactions of an N-Sulfonylamine Inner Salt" J. Am. Chem. Soc. 1968, 90, 4744–4745.
- ↑ Burgess, E. M.; Penton, H. R., Jr.; Taylor, E. A. "Thermal Reactions of Alkyl N-Carbomethoxysulfamate Esters" J. Org. Chem. 1973, 38, 26–31.
- ↑ Burgess, E. M.; Penton, H. R., Jr.; Taylor, E. A.; Williams, W. M. "Conversion of primary alcohols to urethanes. Methyl n-sulfonylurethane triethylamine complexes." Org. Synth. 1973, 53, 1857.
- ↑ O'Grodnick, J. S.; Ebersole, R. C.; Wittstruck, T.; Caspi, E. "Trans dehydration of alcohols with methyl (carboxysulfamoyl)triethylammonium hydroxide inner salt." J. Org. Chem. 1974, 39, 2124-2126.
- ↑ Burgess, E. M.; Penton, H. R., Jr.; Taylor, E. A.; Williams, W. M. "Conversion of primary alcohols to urethanes via the inner salt of methyl (carboxysulfamoyl)triethylammonium hydroxide: methyl n-hexylcarbamate." Org. Synth. 1977, 56, 40-43.
Wikimedia Foundation.
