- N-Hydroxysuccinimid
-
Strukturformel 
Allgemeines Name N-Hydroxysuccinimid Andere Namen 1-Hydroxy-2,5-pyrrolidindion
Summenformel C4H5NO3 CAS-Nummer 6066-82-6 PubChem 80170 Kurzbeschreibung farb- und geruchloser kristalliner Feststoff[1]
Eigenschaften Molare Masse 115,09 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit gut löslich in Wasser[3]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. N-Hydroxysuccinimid (NHS, in Strukturformeln meist als HOSu abgekürzt, nach IUPAC 1-Hydroxy-2,5-pyrrolidindion) ist das N-Hydroxy-Derivat von Succinimid. Die Substanz wird in organischen Synthesen vor allem zur Herstellung sogenannter NHS-Ester verwendet.
Inhaltsverzeichnis
Eigenschaften
N-Hydroxysuccinimid ist ein farb- und geruchloser kristalliner Feststoff. Es ist in Wasser leicht löslich und zeigt darin eine schwach saure Reaktion. NHS ist ein schwaches Oxidationsmittel.
Verwendung
In chemischen und biochemischen Synthesen ist N-Hydroxysuccinimid eine vielseitig und häufig eingesetzte Verbindung.
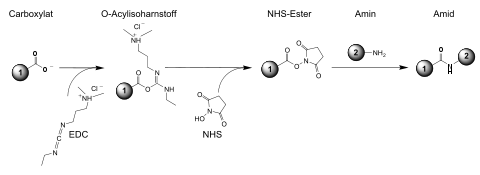
Durch Umsetzung mit einer Carbonsäure und einem Aktivierungs-Reagenz, wie beispielsweise Dicyclohexylcarbodiimid (DCC) oder 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid (EDC), werden damit NHS-Ester hergestellt. NHS-Ester sind „aktivierte Carbonsäuren“ und reagieren leicht mit Aminofunktionen – beispielsweise von Peptiden oder Proteinen –, die deutlich nukleophiler als Alkohole sind.[4]
NHS-Ester sind weitgehend hydrolysestabil.[5]
Ähnliche Reagenzien zur Aktivierung von Carbonsäuren sind 1-Hydroxybenzotriazol (HOBT), 1-Hydroxy-7-azabenzotriazol (HOAT) und Pentafluorphenol.
Die oxidierenden Eigenschaften von NHS können zur Ruthenium-katalysierten Umwandlung endständiger Alkine in Carbonsäure-Derivate genutzt werden.[6]
Die Verwendung von NHS zur Herstellung von Aktivestern wurde erstmals 1963 von George W. Anderson, Joan E. Zimmerman und Francis M. Callahan beschrieben.[7]
Toxikologie
N-Hydroxysuccinimid ist im Tiermodell Maus und Ratte weder kanzerogen noch teratogen. Bei der Backhefe Saccharomyces cerevisiae löst es keine mitotischen Genveränderungen aus.[8]
Einzelnachweise
- ↑ a b Datenblatt N-Hydroxysuccinimid bei Merck, abgerufen am 21. Februar 2010.
- ↑ Succinimid. In: Römpp Online. Stand April 2007
- ↑ Thermo Scientific: Instructions NHS Sulfo-NHS.
- ↑ M. A. Gauthier u. a.: Synthese funktioneller Polymere durch polymeranaloge Reaktionen.' In: Angew Chem 121, 2009, S. 50–60. doi: 10.1002/ange.200801951
- ↑ E. Pedone u. a.: An information rich biomedical polymer library. In: J Mater Chem 13, 2003, S. 2825–2837. ISSN 0959-9428
- ↑ B. M. Trost u. a.: Ruthenium-katalysierte Reaktionen – eine Schatzkiste für atomökonomische Umwandlungen. In: Angew Chem 117, 2005, S. 6788–6825. doi:10.1002/ange.200500136
- ↑ G. W. Anderson u. a.: N-Hydroxysuccinimide Esters in Peptide Synthesis. In: JACS 85, 1963, S. 3039. doi:10.1021/ja00902a047
- ↑ H. Dannenberg: N-Hydroxy-succinimid, eine nicht krebserzeugende N-Hydroxy-Verbindung. In: Journal of Cancer Research and Clinical Oncology 76, 1971, S. 216–218. doi:10.1007/BF00303565
Literatur
- B. Lygo: Handbook of Reagents for Organic Synthesis – Activating Agents and Protecting Groups. A. J. Pearson und W. R. Roush (Hrsg.), Verlag Wiley, 1999, S. 225–227.
- C. A. Montalbetti und V. Falque: Amide bond formation and peptide coupling. In: Tetrahedron 61, 2005, S. 10827–10852. doi:10.1016/j.tet.2005.08.031
- V. A. Shibnev u. a.: N-hydroxysuccinimide esters in the synthesis of collagen-type structures. In: Russian Chemical Bulletin 18, 1969, S. 2367–2370. doi:10.1007/BF00906511
Wikimedia Foundation.