- Benzotriazol
-
Strukturformel 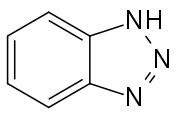
Allgemeines Name Benzotriazol Andere Namen - 1H-Benzotriazol
- 1,2,3-Benzotriazol
Summenformel C6H5N3 CAS-Nummer 95-14-7 Kurzbeschreibung beigefarbener Feststoff[1]
Eigenschaften Molare Masse 119,13 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Siedepunkt 350 °C [2]
Dampfdruck pKs-Wert 8,37 [2]
Löslichkeit schlecht in Wasser (20 g·l−1)[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 
Achtung
H- und P-Sätze H: 302-312-319-412 EUH: keine EUH-Sätze P: 273-280-305+351+338 [3] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
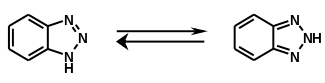
schädlich(Xn) R- und S-Sätze R: 20/22-36-52/53 S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 1H-Benzotriazol ist eine organische Chemikalie, die als Komplexbildner Verwendung findet. Eine strukturisomere Verbindung, mit der 1H-Benzotriazol im tautomeren Gleichgewicht steht, ist das 2H-Benzotriazol.
Inhaltsverzeichnis
Eigenschaften
1H-Benzotriazol ist ein weißes, kristallines Pulver, welches nach Aufreinigung durch mehrmalige Sublimation im Hochvakuum bei 100,5 °C schmilzt.[4] Die Verbindung kristallisiert in einem monoklinen Kristallgitter.[5] Der bei einer Sublimation relevante Dampfdruck liegt im Temperaturbereich zwischen 53,4 °C und 71,7 °C zwischen 0,000695 Torr und 0,0048 Torr und kann mittels der Gleichung lg(p/Pa)=5159,5(T/K)−1+14,77 beschrieben werden.[6] Die Sublimationsenthalpie beträgt bei 25 °C ΔsubH = 98,15 kJ/mol, bei 63,4 °C ΔsubH = 96,30 kJ/mol.[7]
Die Verbindung zersetzt sich oberhalb des Schmelzpunktes stark exotherm.[8] Eine Destillation der Verbindung ist deshalb nicht ratsam. Eine Quelle[9] aus dem Jahr 1956 berichtet von einer explosiven Zersetzung eines 1 t-Ansatzes während der Destillation bei 160 °C und 2,5 mbar. Bei einer thermoanalytischen Untersuchung zeigte sich ab 240 °C eine Zersetzungsreaktion mit einer sehr hohen Reaktionswärme von −1590 kJ/kg.[8] Trotz der hohen Zersetzungswärme ist die Verbindung nicht explosionsgefährlich im Sinne der Sprengstoffgesetzes, da weder im BAM 50/60 Stahlrohrtest noch im Koenentest mit 2 mm Lochdurchmesser ein positives Ergebnis beobachtet wurde.[8] Der Koenentest mit 1 mm Lochdurchmesser verläuft positiv.[8]
Zwischen 1H-Benzotriazol und 2H-Benzotriazol kann ein Tautomeriegleichgewicht formuliert werden. Experimentelle Messungen und quantenchemische Berechnungen zeigen aber, dass in fester Phase sowie in Lösung dieses Gleichgewicht praktisch auf der Seite des 1H-Benzotriazols liegt.[10][11][12] Dieses ist das energetisch günstigere Tautomer. Im photochemisch angeregten Triplettzustand ist allerdings das 2H-Tautomer energetisch begünstigt bzw. stabiler.[11]
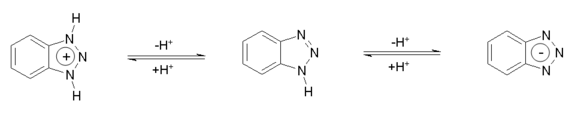
Benzotriazol besitzt amphiprotische Eigenschaften, kann also im sauren Medium protoniert bzw. im basischen Medium deprotoniert werden. Die Protolysekonstanten betragen pKa1 = 0,42 und pKa2 = 8,27.[13]
Gewinnung und Darstellung
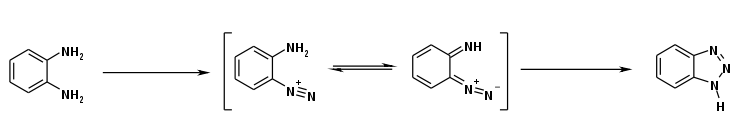
Die Herstellung erfolgt durch ringschließende Diazotierung von o-Phenylendiamin mit Nitrit und (Essig-)Säure.[14]
Verwendung
Benzotriazol wird als Korrosionsschutzmittel in Kühlflüssigkeiten, Frostschutzmitteln und Enteisungsmitteln eingesetzt. In Geschirrspülmitteln dient es als Silberschutz. In der Industrie wird es in Kühlschmiermitteln der Metallbearbeitung eingesetzt. In fotografischen Entwicklern dient es zur Verminderung von Schleierbildung auf dem Film.
Umweltrelevanz
Benzotriazol ist relativ gut wasserlöslich und schwer abbaubar. Es wird daher in Kläranlagen nur zu einem kleinen Anteil eliminiert und gelangt in großen Mengen in Flüsse und Seen.[15]
Einzelnachweise
- ↑ a b c d e f Datenblatt Benzotriazol bei Sigma-Aldrich, abgerufen am 11. Juni 2011.
- ↑ a b c d SRC PhysProp Database: 1H-Benzotriazole
- ↑ a b Eintrag zu CAS-Nr. 95-14-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. März 2011 (JavaScript erforderlich).
- ↑ K.W.F. Kohlrausch, R. Seka; Raman-Effekt und Konstitutions-Probleme, XIII. Mitteil.: Naphthalinartig kondensierte Hetero-bicyclen; Chemische Berichte 71 (1938), 1563–1570 doi:10.1002/cber.19380710803
- ↑ A. Escande, J. L.Galigné, J. Lapasset: Structure cristalline et moléculaire du benzotriazole; Acta Cryst. B 30 (1974), 1490–1495; doi:10.1107/S0567740874005139
- ↑ P. Jimenez, M. V. Roux, C. Turrion: Thermochemical properties of N-heterocyclic compounds II. Enthalpies of combustion, vapour pressures, enthalpies of sublimation, and enthalpies of formation of 1,2,4-triazole and benzotriazole; J. Chem. Thermodyn. 21 (1989), 759–764; doi:10.1016/0021-9614(89)90060-8
- ↑ R. Sabbah, L. Perez; Energetics of Intramolecular Bonds in 1H-1,2,4-Triazole and 1H-Benzotriazole, in: Austr. J. Chem. 1999, 52, 235–240; doi:10.1071/C99006.
- ↑ a b c d M. Malow, K. D. Wehrstedt, S. Neuenfeld: On the explosive properties of 1H-benzotriazole and 1H-1,2,3-triazole. Tetrahedron Letters 48 (2007), 1233–1235;doi:10.1016/j.tetlet.2006.12.046
- ↑ Anon., Chem. Eng. News, 1956, 34, 2450
- ↑ F. Tomas; J.L.M. Abboud; J. Laynez; R. Notario; L. Santos; S.O. Nilsson; R.M. Claramunt; J Elguero: Tautomerism and aromaticity in 1,2,3-triazoles: The case of Benzotriazole in J. Am. Chem. Soc. 111 (1989) 7348-7353.doi:10.1021/ja00201a011
- ↑ a b J. Catalan; P. Perez: Theoretical and experimental evidence on the structure of benzotriazole in its first triplet electronic state in Chem. Phys. Letters 404 (2005) 304-308.doi:10.1016/J.cplett.2005.01.107
- ↑ A.R. Katritzky; K. Yannakopoulou; E. Anders; J. Stephens; M. Szafran: Ab initio and semiempirical calculations on the tautomeric equilibria of N-unsubstituted and N-substituted benzotriazoles in J. Org. Chem. 55 (1990 5683-5687. doi:10.1021/jo00309a009
- ↑ H. Wang, C. Burda, G. Persy, J. Wirz: Photochemistry of 1H-Benzotriazole in Aqueous Solution: A Photolatent Base in J. Am. Chem. Soc. 122 (2000) 5849-5855;doi:10.1021/ja994464c
- ↑ U.S. Patent 4299965
- ↑ W. Giger, C. Schaffner, HP. Kohler (2006): Benzotriazole and Tolyltriazole as Aquatic Contaminants. 1. Input and Occurrence in Rivers and Lakes. Environ. Sci. Technol. 40, S. 7186–7192. PMID 17180965
Weblinks
Wikimedia Foundation.