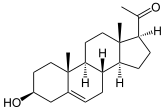
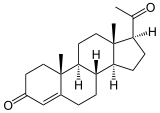
- 3beta-Hydroxysteroid-Dehydrogenase
-
3beta-Hydroxysteroid-Dehydrogenase —
Masse/Länge Primärstruktur 371 / 372 / 369 Aminosäuren Sekundär- bis Quartärstruktur single-pass Membranprotein (ER, Mit.) Isoformen NP_000853, NP_000189, NP_079469 Bezeichner Gen-Name(n) HSD3B1, HSD3B2, HSD3B7 Externe IDs OMIM: 201810 Enzymklassifikationen EC, Kategorie 1.1.1.145 Oxidoreduktase Reaktionsart Dehydrierung Substrat Pregnenolon + NAD+ Produkte Pregn-5-en-3,20-dion + NADH/H+ EC, Kategorie 5.3.3.1 Isomerase Reaktionsart Umlagerung Substrat Pregn-5-en-3,20-dion Produkte Progesteron Vorkommen Übergeordnetes Taxon mehrzellige Tiere, Protozoen[1] 3β-Hydroxysteroid-Dehydrogenase (3β-HSD) heißen Enzyme, die in Steroiden die 3β-Hydroxygruppe zum Keton reduzieren und gleichzeitig die Umlagerung der Doppelbindung von der 5- in die 4-Position katalysieren. Diese Reaktion wird in Wirbeltieren bei der Biosynthese von Progesteron aus Pregnenolon benötigt, genauso wie bei der Umwandlung von Dehydroepiandrosteron zu Androstendion oder von 17α-Hydroxy-Pregnenolon zu 17α-Hydroxyprogesteron.
3β-HSD sind Transmembranproteine und lokalisieren zum endoplasmatischen Retikulum und zu den Mitochondrien. Beim Mensch sind drei paraloge Isoformen bekannt, die in unterschiedlichen Gewebetypen exprimiert werden: 3β-HSD I hauptsächlich in den Brustdrüsen, der Plazenta und der Haut; 3β-HSD II vor allem in Nebennieren, Hoden und Eierstöcken. Mutationen im HSD3B2-Gen sind verantwortlich für ein adrenogenitales Syndrom Typ 2 (Congenitale adrenale Hyperplasie).[2][3] Das dritte menschliche Enzym dieser Proteinfamilie ist 3β-HSD Typ 7, ein Enzym der Gallensäurebildung aus Cholesterin.[4]
Inhaltsverzeichnis
Katalysierte Reaktionen
Pregnenolon wird zu Progesteron umgesetzt. Es findet nacheinander eine Dehydrierung zum Keton und eine Umlagerung der Doppelbindung statt. Eine weitere Reaktion ist die Umsetzung von DHEA zu Androstendion.[5]
Strukturverweis
Strukturmodell von HSD3B1: JPEG aus [6]
Einzelnachweise
- ↑ Homologe bei inParanoid
- ↑ UniProt P26439, UniProt P14060
- ↑ Welzel M, Wüstemann N, Sîmić-Schleicher G, et al.: Carboxyl-Terminal Mutations in 3β-Hydroxysteroid Dehydrogenase Type II Cause Severe Salt-Wasting Congenital Adrenal Hyperplasia. In: J. Clin. Endocrin. Metabol.. 93, S. 1418-25.
- ↑ Simard J, Ricketts M-L, Gingras S et al.: Molecular Biology of the 3β-Hydroxysteroid Dehydrogenase/Δ5-Δ4 Isomerase Gene Family. In: Endocrine Rev.. 26, 2005, S. 525-582. doi:10.1210/er.2002-0050. PMID 15632317.
- ↑ Pletnev VZ, Thomas JL, Rhaney FL, et al.: Rational proteomics V: structure-based mutagenesis has revealed key residues responsible for substrate recognition and catalysis by the dehydrogenase and isomerase activities in human 3beta-hydroxysteroid dehydrogenase/isomerase type 1. In: J. Steroid Biochem. Mol. Biol.. 101, Nr. 1, September 2006, S. 50–60. doi:10.1016/j.jsbmb.2006.06.004. PMID 16889958. Volltext bei PMC: 1971842.
- ↑ Thomas JL, et al.: Structure/Function Relationships Responsible for Coenzyme Specificity and the Isomerase Activity of Human Type 1 3β-Hydroxysteroid Dehydrogenase/Isomerase. In: J.Biol.Chem.. 278, 2003, S. 35483-90. PMID 12832414.
Weblinks
 Wikibooks: Biochemie und Pathobiochemie: Steroidhormon-Stoffwechsel – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: Steroidhormon-Stoffwechsel – Lern- und Lehrmaterialien- Jassal / reactome: Pregnenolone is dehydrogenated to form pregn-5-ene-3,20-dione
- Jassal / reactome: Pregn-5-ene-3,20-dione isomerizes to progesterone
- Jassal / reactome: DHA isomerizes to 4-Androstene3,17-dione
Kategorien:- Isomerase
- Oxidoreduktase
- Multifunktionelles Enzym
- Steroidhormonbiosynthese
Wikimedia Foundation.