- 9-Borabicyclo(3.3.1)nonan
-

Der korrekte Titel dieses Artikels lautet „9-Borabicyclo[3.3.1]nonan“. Diese Schreibweise ist aufgrund technischer Einschränkungen nicht möglich. Strukturformel 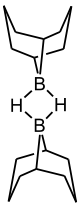
Kristallsystem monoklin (Dimer)[1]
Raumgruppe C2/m (Dimer)[1]
Gitterkonstanten a = 1454 pm
b = 1549 pm
c = 688 pm
β = 92,7° (Dimer)[1]Allgemeines Name 9-Borabicyclo[3.3.1]nonan Andere Namen - 9-BBN (Monomer)
- (9-BBN)2 (Dimer)
- Bis-9-Borabicyclo[3.3.1]nonan (Dimer)
Summenformel - C8H15B (Monomer)
- C16H30B2 (Dimer)
CAS-Nummer - 280-64-8 (Monomer)
- 21205-91-4 (Dimer)
PubChem 6327450 Eigenschaften Molare Masse Aggregatzustand fest
Schmelzpunkt Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 

Gefahr
H- und P-Sätze H: 225-260-319-335 EUH: keine EUH-Sätze P: 210-223-231+232-261-370+378-422 [3] EU-Gefahrstoffkennzeichnung [4] 
Leicht-
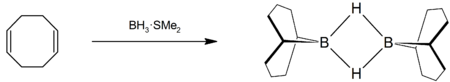
entzündlich(F) R- und S-Sätze R: 11-14/15-17 S: 7/8-30-33-43 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 9-Borabicyclo[3.3.1]nonan, häufig als 9-BBN abgekürzt, ist ein Organoboran. Der farblose Feststoff wird in der organischen Chemie als Reagenz zur Hydroborierung benutzt. Die Verbindung ist ein über die Wasserstoffatome verknüpftes Dimer, das bei Anwesenheit eines reduzierbaren Substrates leicht gespalten wird.[5] Wie andere Organoborverbindungen ist auch 9-BBN pyrophor und wird daher meistens als Lösung in Tetrahydrofuran eingesetzt.
Als Feststoff liegt 9-BBN ausschließlich als Dimeres vor, ebenso in gewissen organischen Lösungsmitteln; es kann in Lösung jedoch auch ein Gleichgewicht zwischen der dimeren und der (mit dem Lösungsmittel komplexierten) monomeren Form vorliegen.[6]
Inhaltsverzeichnis
Darstellung
9-BBN wird durch die Umsetzung von 1,5-Cyclooctadien mit Boran-Komplexen, etwa mit Tetrahydrofuran oder Dimethylsulfid, in etherischer Lösung hergestellt.[7][8]
Verwendung
9-BBN kann neben der Hydroborierung auch in Suzuki-Reaktionen eingesetzt werden.[9] Durch seine hohe sterische Hinderung durch den Cyclooctyl-Substituenten führt 9-BBN bei der Hydroborierungsreaktion im Vergleich zu Boranen praktisch ausschließlich zum Anti-Markownikow-Produkt.
Einzelnachweise
- ↑ a b c D. J. Brauer, C. Krüger: "The Crystal and Molecular Structure of Bis-9-borabicyclo[3,3,1]nonane: a Study of the Boron-Carbon Bond"; Acta Cryst. (1973), B29, S. 1684–1690; doi:10.1107/S0567740873005261.
- ↑ MSDS von Fisher Scientific
- ↑ a b Datenblatt 9-Borabicyclo[3.3.1]nonane solution bei Sigma-Aldrich, abgerufen am 18. März 2011.
- ↑ Datenblatt 9-Borabicyclo[3.3.1]nonane bei AlfaAesar, abgerufen am 2. Juni 2011 (JavaScript erforderlich).
- ↑ H. C. Brown: Organic Syntheses via Boranes. John Wiley & Sons, Inc. New York 1975, ISBN 0-471-11280-1.
- ↑ Herbert C. Brown, Kung K. Wang, Charles G. Scouten: "Hydroboration kinetics: Unusual kinetics for the reaction of 9-borabicyclo[3.3.1]nonane with representative alkenes"; Proc Natl Acad Sci USA, Februar 1980, 77 (2), S. 698–702; Abstract.
- ↑ John A. Soderquist, Herbert C. Brown: Simple, remarkably efficient route to high purity, crystalline 9-borabicyclo[3.3.1]nonane (9-BBN) dimer, J. Org. Chem., 1981, 46, 22, S. 4599–4600, doi:10.1021/jo00335a067.
- ↑ John A. Soderquist, Alvin Negron: 9-Borabicyclo[3.3.1]nonane Dimer. In: Organic Syntheses. Coll. Vol. 9, p. 95 (1998); Vol. 70, p. 169 (1992); PDF.
- ↑ Tatsuo Ishiyama, Norio Miyaura, Akira Suzuki: Palladium(0)-catalyzed reaction of 9-alkyl-9-borabicyclo[3.3.1]nonane with 1-bromo-1-phenylthioethene: 4-(3-cyclohexenyl)-2-phenylthio-1-butene. In: Organic Syntheses. Coll. Vol. 9, p. 107 (1998); Vol. 71, p. 89 (1993); PDF.
Weblinks
Wikimedia Foundation.