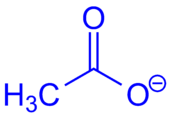
- Acetate
-
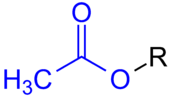 Allgemeine Struktur von Essigsäureestern mit dem blau markierten Acetat-Rest. R ist ein Organyl-Rest, wie Alkyl-Rest, Aryl-Rest oder Arylalkyl-Rest etc. – im häufig benutzten Lösungsmittel Ethylacetat ist R ein Ethylrest.
Allgemeine Struktur von Essigsäureestern mit dem blau markierten Acetat-Rest. R ist ein Organyl-Rest, wie Alkyl-Rest, Aryl-Rest oder Arylalkyl-Rest etc. – im häufig benutzten Lösungsmittel Ethylacetat ist R ein Ethylrest.
Als Acetate (oder auch Ethanoate) werden die Salze und Ester der Essigsäure bezeichnet. Die Salze haben die allgemeine Struktur CH3COO−M+, abgekürzt auch: AcO−M+ (M+ ist ein einwertiges Kation). Die Ester haben die allgemeine Struktur CH3COOR (AcOR), wobei R ein aliphatischer, aromatischer oder ein heterocyclischer Rest sein kann.
Inhaltsverzeichnis
Salze
Die Salze sind zumeist farblose, kristalline Feststoffe, die in ihren Kristallgittern (Ionengittern) das Acetat-Ion (CH3COO−, AcO−) enthalten. Dieses ist das Anion der Essigsäure. Beispiele für salzartige Acetate sind Natriumacetat (CH3COONa), Kaliumacetat (CH3COOK) oder auch Ammoniumacetat (CH3COONH4). Mit zweiwertigen Kationen bilden sich Salze wie Calciumacetat ((CH3COO)2Ca) oder Blei(II)-acetat (CH3COO)2Pb).
Darstellung
Die Salze gewinnt man durch Neutralisation der Essigsäure mit Metallhydroxiden oder Metalloxiden:

- Essigsäure und Natriumhydroxid reagieren zu Natriumacetat und Wasser.

- Essigsäure und Blei(II)-oxid ergeben Bleiacetat und Wasser.
Acetat-Nachweis
In der chemischen Analytik können Acetate leicht nachgewiesen werden, indem man die Probe mit Kaliumhydrogensulfat im Mörser zerreibt. Dabei wird das Proton (H+) des Hydrogensulfat-Ions auf das Acetation übertragen, wobei die flüchtige Essigsäure entsteht, die leicht durch ihren typischen Geruch identifiziert werden kann:

- Acetat wird durch Hydrogensulfat protoniert. Es entsteht Essigsäure und Sulfat.
Ester
Essigsäureester (CH3COOR) werden oft Acetate genannt. Ethylacetat (Essigsäureethylester) ist der bekannteste dieser Ester. Ester mit niedermolekularen Resten sind in der Regel flüssig und werden als Lösemittel verwendet. Einige dieser Ester, wie zum Beispiel Linalylacetat, werden als Riech- oder Aromastoff verwendet. Ein makromolekularer Essigsäureester ist z.B. der Kunststoff Celluloseacetat.
Darstellung
Die Acetate CH3COOR erhält man durch eine Veresterung der Essigsäure mit Alkoholen (R-OH) oder durch Umsetzung von Acetylchlorid mit Alkoholen.

- Essigsäure und Alkohol reagieren in einer Kondensationsreaktion zu einem Essigsäureester und Wasser.
Vorkommen
Acetate kommen in allen biologischen Organismen als Stoffwechselprodukte vor. Darüber hinaus gibt es einige sehr seltene Mineralien wie Hoganit, Paceit und Calclacit auf Basis von Acetaten. Diese werden sowohl durch die Strunzsche Mineralsystematik und die Systematik der Minerale nach Dana in die Gruppe der organischen Mineralien eingruppiert. Acetate als natürlich vorkommende Mineralien sind extrem selten, trotzdem Essigsäure in der Natur weit verbreitet ist. Bis zur Anerkennung des Hoganits als Mineral (2002), war Calclacit der einzig bekannte Vertreter dieser Stoffklasse, wobei er anthropogenen Ursprungs ist. Es wurde bis dahin vermutet, dass Calclacit der einziger Vertreter der Acetate bleiben wird und eine rein natürliche Bildung von anderen Acetaten wurde als sehr unwahrscheinlich erachtet. Mit der Anerkennung des Hoganits und des Paceits die IMA sind dies die ersten Vertreter dieser Stoffklasse, die ohne anthropogenen Einfluss entstanden sind. [1]
Siehe auch
Bisweilen wird der Acetatrest mit dem Acetylrest verwechselt. Der Acetylrest enthält ein Sauerstoffatom weniger als der Acetatrest und zählt zur Gruppe der Acylreste.
Einzelnachweise
Weblinks
Wikimedia Foundation.