- Calciumphosphat
-
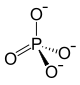
Strukturformel 
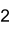
Allgemeines Name Calciumphosphat Andere Namen - Tricalciumphosphat
- Tribasisches Calciumphosphat
- Calciumorthophosphat
- Tricalciummonophosphat
- Tertiäres Calciumphosphat
- E 341
Summenformel Ca3(PO4)2 CAS-Nummer 7758-87-4 PubChem 24456 ATC-Code A12AA01
Kurzbeschreibung weißer, geruchloser Feststoff[1]
Eigenschaften Molare Masse 310,18 g·mol−1 Aggregatzustand fest
Dichte 3,14 g·cm−3[1]
Schmelzpunkt Löslichkeit praktisch unlöslich in Wasser (0,02 g·l−1 bei 20 °C)[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 >5000 mg·kg−1 (Ratte, peroral)[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Calciumphosphat, Tricalciumorthophosphat oder Tricalciumphosphat (Ca3(PO4)2) ist ein Calciumsalz der ortho-Phosphorsäure und gehört zu den Phosphaten. Der Begriff Tricalciumphosphat wird gelegentlich für die sehr ähnliche Verbindung Pentacalciumhydroxytriphosphat (Ca5(PO4)3·OH) verwendet.
Inhaltsverzeichnis
Vorkommen
In der Natur kommt Calciumphosphat nicht in reiner Form vor. Mineralische Calciumphosphate wie zum Beispiel Apatit oder Phosphorit enthalten immer noch andere Anionen.[3] Von beiden gibt es große Lagerstätten, technische Bedeutung zur Produktion von Phosphor und Dünger (Superphosphat) besitzen aber lediglich die Apatite.[4]
Eigenschaften
Calciumphosphat ist ein farb- und geruchloser Feststoff, der bei 1670 °C schmilzt. Es ist praktisch unlöslich in Wasser.
Verwendung
Man verwendet das (wasserunlösliche) tertiäre Calciumphosphat zur Herstellung des (wasserlöslichen) primären Calciumphosphats Ca(H2PO4)2, besser bekannt als Superphosphat, einem weit verbreiteten Düngemittel.[5]
Calciumphosphat dient auch zur Herstellung von Phosphorsäure, indem es mit Schwefelsäure reagiert:[6]

Calciumphosphat wird verwendet als Lebensmittelzusatzstoff (E 341c), z. B. für Fertigkuchenmischungen, bei denen es als Trennmittel ein Klumpen verhindern und die Rieselfähigkeit erhalten soll.
In der Medizintechnik wird Tricalciumphosphat als synthetisches Knochenersatzmaterial eingesetzt; es wird langsam resorbiert und durch Eigenknochen ersetzt.[7]
Einzelnachweise
- ↑ a b c d e Eintrag zu Calciumphosphat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. März 2010 (JavaScript erforderlich)
- ↑ Datenblatt Calciumphosphat bei Merck, abgerufen am 19. Januar 2011.
- ↑ Holleman-Wiberg: Lehrbuch der Anorganischen Chemie. 91.-100. Auflage, Walter de Gruyter, 1985, S.655
- ↑ N. N. Greenwood, A. Earnshaw: Chemie der Elemente. VCH 1988, S. 611, 675.
- ↑ N. N. Greenwood, A. Earnshaw: Chemie der Elemente. VCH 1988, S. 675.
- ↑ Holleman-Wiberg: Lehrbuch der Anorganischen Chemie. 91.-100. Auflage, Walter de Gruyter, 1985, S.652
- ↑ Langenbeck's Archives of Surgery Volume 341, Number 2, 77-86, Experimenteller Knochenersatz durch resorbierbare Calciumphosphat-Keramik, doi:10.1007/BF01262779
Weblinks
Kategorien:- ATC-A12
- Calciumverbindung
- Phosphat
- Arzneistoff
- Säuerungsmittel
Wikimedia Foundation.
