- Bromthiophene
-
Monobromthiophene Name 2-Bromthiophen 3-Bromthiophen Andere Namen α-Bromthiophen
2-Thienylbromidβ-Bromthiophen
3-ThienylbromidStrukturformel 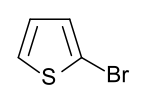
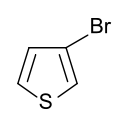
CAS-Nummer 1003-09-4 872-31-1 PubChem 13851 13383 Summenformel C4H3BrS Molare Masse 163,04 g·mol−1 Aggregatzustand flüssig Beschreibung farblose, klare,
stinkende Flüssigkeit[1]hellbraune, klare,
stinkende Flüssigkeit[2]Schmelzpunkt −10 °C[3] <−10 °C[4] Siedepunkt 149–151 °C[1] 150 °C[2] Flammpunkt 52 °C[1] 52 °C[2] Dichte 1,684 g/cm3 (25 °C)[1] 1,74 g/cm3 (25 °C)[2] Dampfdruck Löslichkeit nicht mischbar mit Wasser[3][5] Brechungsindex 1,586 (20 °C)[1] 1,591 (20 °C)[2] GHS-
Einstufung

Gefahr[1]
Gefahr[2]

H- und P-Sätze 226-300-318 226-301-310-317
319-330-335keine EUH-Sätze keine EUH-Sätze 264-280-301+310
305+351+338260-280-284-302+350
305+351+338-310Gefahrstoff-
kennzeichnung
[1][2]
Giftig (T) 

Giftig Umwelt-
gefährlich(T) (N) R-Sätze 10-25-41[1] 10-23/24/25-36/37-43-51/53 [2] S-Sätze 26-36/37/39-45[1] 26-36/37-45-61 [2] LD50 35 mg·kg−1 (oral, Ratte)[1] 66-160 mg·kg−1 (oral, Ratte)[2] Bromthiophene ist der Sammelbegriff für zwei isomere chemische Verbindungen, die zu den Heterocyclen zählen.
Inhaltsverzeichnis
Darstellung
2-Bromthiophen
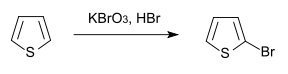
Die direkte Bromierung von Thiophen mit elementarem Brom liefert neben 2-Bromthiophen auch erhebliche Mengen von 2,5-Dibromthiophen. Wird die Bromierung mit Kaliumbromat und Bromwasserstoff durchgeführt, erfolgt nur einfache Substitution.[6]
3-Bromthiophen
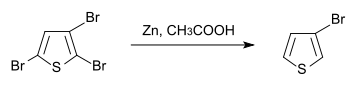
3-Bromthiophen kann aus 2,3,5-Tribromthiophen, das leicht durch direkte Bromierung von Thiophen zugänglich ist[7], durch Debromierung mit Zinkstaub in Essigsäure hergestellt werden.[8][9]
Reaktionen
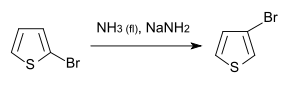
Wenn 2-Bromthiophen in flüssigem Ammoniak mit Natriumamid behandelt wird, findet eine Isomerisierung zu 3-Bromthiophen statt.[10]
Die Isomerisierung kann mit guten Ausbeuten auch mit Zeolith-Katalysatoren durchgeführt werden.[11]
Verwendung
3-Bromthiophen ist die wichtigste Ausgangssubstanz zur Synthese von 3-substituierten Thiophenen.[8][7]
Einzelnachweise
- ↑ a b c d e f g h i j Datenblatt 2-Bromthiophen bei Sigma-Aldrich, abgerufen am 16. März 2011.
- ↑ a b c d e f g h i j Datenblatt 3-Bromthiophen bei Sigma-Aldrich, abgerufen am 16. März 2011.
- ↑ a b Datenblatt 2-Bromthiophen bei ChemBlink, abgerufen am 16. März 2011.
- ↑ Datenblatt 3-Bromthiophen bei ChemicalBook, abgerufen am 19. September 2011.
- ↑ Datenblatt 3-Bromthiophen bei ChemBlink, abgerufen am 16. März 2011.
- ↑ Y. L. Goldfarb, A. A. Dudinov, V. P. Litvinov: „New method for preparation of 2-bromothiophene“, in: Russian Chemical Bulletin, 1982, 31 (10), S. 2104–2105; doi:10.1007/BF00950665.
- ↑ a b A. R. Katritzky: Advances in Heterocyclic Chemistry, Verlag Academic Press, 1963, ISBN 978-0-12020601-8, S. 41 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ a b S. Gronowitz: „New Syntheses of 3-Bromothiophene and 3,4-Dibromothiophene“, in: Acta Chemica Scandinavica, 1959, 13, S. 1045–1046; doi:10.3891/acta.chem.scand.13-1045; Volltext.
- ↑ S. Gronowitz, T. Raznikiewicz: 3-Bromothiophene. In: Organic Syntheses. Coll. Vol. 5, p. 149 (1973); Vol. 44, p. 9 (1964); PDF.
- ↑ L. Brandsma, R. L. P. de Jong: „A Large-Scale Procedure for the Preparation of 3-Bromothiophene from 2-Bromothiophene and Sodamide in Liquid Ammonia“, in: Synthetic Communications, 1990, 20 (11), S. 1697–1700; doi:10.1080/00397919008053091.
- ↑ C. Werner, A. Kanschik-Conradsen, B. Kellermeier, H.-J. Schmidt: „Process for isomerization of 2-halothiophene to 3-halothiophene“, United States Patent 7208610. Volltext
Kategorien:- Giftiger Stoff
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff
- Thiophen
- Bromverbindung
Wikimedia Foundation.