- Cobaltcarbonylhydrid
-
Strukturformel 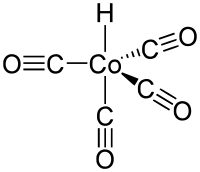
Allgemeines Name Cobaltcarbonylhydrid Andere Namen - Tetracarbonylhydridocobalt
- Cobaltcarbonylwasserstoff
- Cobalttetracarbonylhydrid
- Cobalthydrocarbonyl
Summenformel C4HCoO4 CAS-Nummer 16842-03-8 PubChem 61848 Kurzbeschreibung gelbliche Flüssigkeit[1]
Eigenschaften Molare Masse 171,98 g·mol−1 Aggregatzustand flüssig
Schmelzpunkt Siedepunkt Zersetzung ab -18 °C [1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cobaltcarbonylhydrid ist eine chemische Verbindung des Cobalts und zählt zu den Carbonylkomplexen. Neben Carbonylliganden ist zusätzlich ein Wasserstoffatom an das Cobaltatom gebunden. Es handelt sich um eine gelbliche, luftempfindliche, sich leicht zersetzende Flüssigkeit.
Inhaltsverzeichnis
Gewinnung und Darstellung
Cobaltcarbonylhydrid lässt sich aus Dicobaltoctacarbonyl darstellen. Dazu wird Dicobaltoctacarbonyl mit Natrium umgesetzt, wodurch die Cobalt-Cobalt-Bindung gebrochen wird und sich Natriumtetracarbonylcobaltat bildet. Durch Umsetzen mit einer Säure entsteht Cobaltcarbonylhydrid.[3]
Technisch wird Cobaltcarbonylhydrid durch reduktive Carbonylierung von Cobaltoxiden mit Kohlenstoffmonoxid und Wasserstoff hergestellt. Dabei bildet sich zunächst Dicobaltoctacarbonyl, was durch den Wasserstoff gespalten wird.[4]
Eigenschaften
Der Cobaltcarbonylhydrid-Komplex ist trigonal-dipyramidisch aufgebaut. Dabei ist das Wasserstoffatom und ein Carbonylligand axial, die drei weiteren Carbonylliganden äquatorial angeordnet. Der Cobalt-Wasserstoff-Abstand beträgt 114 pm, der Cobalt-Kohlenstoff-Abstand 176 pm für den axialen CO-Liganden bzw. 182 pm für die äquatorialen CO-Liganden.[5]
Der Wasserstoff-Ligand ist sauer und kann leicht abgespalten werden. Der pKs-Wert des Komplexes liegt bei 8,3, gemessen in Acetonitril.[6]
Verwendung
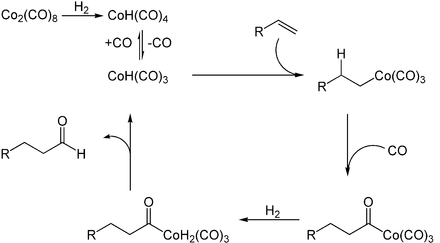
Cobaltcarbonylhydrid wird industriell in der Hydroformylierung verwendet. Dabei dient der Komplex als Katalysator zur Gewinnung von Aldehyden aus Alkenen. Er ermöglicht die Insertion von Kohlenstoffmonoxid in eine C-H-Bindung des Alkens.[4]
Die Synthese mittels Cobalt-Katalysatoren ist jedoch häufig durch Rhodium-Katalysatoren ersetzt worden, da diese mildere Reaktionsbedingungen und eine selektivere Reaktion ermöglichen.[4]
Einzelnachweise
- ↑ a b c Eintrag zu Cobaltcarbonylwasserstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 24. August 2011 (JavaScript erforderlich).
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Christoph Elschenbroich: Organometallchemie. 6. Auflage, Teubner Wiesbaden, 2008, ISBN 978-3-8351-0167-8, S. 349.
- ↑ a b c Christoph Elschenbroich: Organometallchemie. 6. Auflage, Teubner Wiesbaden, 2008, ISBN 978-3-8351-0167-8, S. 633-637.
- ↑ E. A. McNeill, F. R. Scholer: Molecular structure of the gaseous metal carbonyl hydrides of manganese, iron, and cobalt. In: Journal of the American Chemical Society. 99, 1977, S. 6243–6249, doi:10.1021/ja00461a011.
- ↑ Eric J. Moore, Jeffrey M. Sullivan, Jack R. Norton: Kinetic and thermodynamic acidity of hydrido transition-metal complexes. 3. Thermodynamic acidity of common mononuclear carbonyl hydrides. In: Journal of the American Chemical Society. 108, 1986, S. 2257–2263, doi:10.1021/ja00269a022.
Kategorien:- Cobaltverbindung
- Wasserstoffverbindung
- Carbonylkomplex
- Katalysator
Wikimedia Foundation.