- Acetonitril
-
Strukturformel 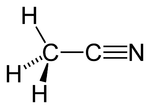
Allgemeines Name Acetonitril Andere Namen - Methylcyanid
- Ethannitril
- Azetonitril
- Essigsäurenitril
- Ethansäurenitril
- Cyanomethan
Summenformel C2H3N CAS-Nummer 75-05-8 PubChem 6342 Kurzbeschreibung farblose, leicht entzündliche Flüssigkeit mit aromatischem Geruch[1]
Eigenschaften Molare Masse 41,05 g·mol−1 Aggregatzustand flüssig
Dichte 0,78 g·cm−3[1]
Schmelzpunkt Siedepunkt 82 °C [1]
Dampfdruck Löslichkeit Mit Wasser vollständig mischbar[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 

Gefahr
H- und P-Sätze H: 225-332-302-312-319 EUH: keine EUH-Sätze P: 210-305+351+338-403+235 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Leicht-
entzündlichGesundheits-
schädlich(F) (Xn) R- und S-Sätze R: 11-20/21/22-36 S: (1/2)-16-36/37 MAK 20 ml·m−3, 34 mg·m−3[1]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Acetonitril ist ein organisches Lösungsmittel und gehört zur Stoffgruppe der Nitrile.
Inhaltsverzeichnis
Herstellung
Möglichkeiten zur Herstellung sind nucleophile Substitutionsreaktionen von z. B. Brommethan mit Natriumcyanid (NaCN).
Im folgenden Beispiel reagieren Brommethan und Natriumcyanid zu Natriumbromid und Acetonitril:
Industriell fällt Acetonitril bei der Herstellung von Acrylnitril in relativ geringen Mengen als Nebenprodukt an. Preis und Verfügbarkeit sind daher an die Produktion des Polyacrylnitrils gekoppelt.
Eigenschaften
Bei starkem Erhitzen und im Brandfall entstehen aus Acetonitril giftige Gase wie Cyanwasserstoff und Stickoxide. Mit Luft entstehen explosionsfähige Gemische.
Acetonitril greift Gummi an und löst viele Polymere. Mit Säuren tritt Polymerisation ein.
Es bildet mit Wasser ein azeotropes Gemisch aus 83,7 Gew.-% Acetonitril zu 16,3 Gew.-% Wasser und einem Siedepunkt von 76,5 °C, 5,5 °C unter dem Siedepunkt von reinem Acetonitril.[4]
Verwendung
Acetonitril ist ein gebräuchliches Lösungsmittel im Labor, in der chemischen Analytik (beispielsweise HPLC) und in der technischen Chemie, dort hauptsächlich zur Extraktion von 1,3-Butadien. Acetonitril dient als Lösemittel für Leitsalze in Doppelschichtkondensatoren.[5]
Sicherheitshinweise
Acetonitril wirkt reizend. Es ist gesundheitsschädlich beim Einatmen, Verschlucken und Hautkontakt. Acetonitril wird durch die Haut (perkutan) resorbiert und wirkt im Körper als Blutgift.
Acetonitril weist bei geringer Dosierung nur eine geringe Toxizität auf.[6][7] Es wird zu Cyanwasserstoff metabolisiert, welches die Ursache für die beobachteten Symptome darstellt.[8][9][10] Die Symptome treten gewöhnlich zeitverzögert auf (zwischen 2 und 12 Stunden), da es einiger Zeit bedarf, bis der Körper das Acetonitril zum Cyanid metabolisiert hat.[7]
Fälle von Vergiftungserscheinungnen durch Inhalation, orale Einnahme oder Hautresorption beim Menschen sind selten, aber nicht unbekannt.[9] Zu den Symptomen, die erst einige Stunden nach Exposition auftreten, zählen Atmungsschwierigkeiten, niedriger Puls, Übelkeit und Brechreiz. In ernsten Fällen können Krämpfe und Koma auftreten, gefolgt vom Tod durch respiratorischem Versagen. Die Gegenmaßnahmen sind wie bei einer Cyanidvergiftung.[9]
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu Acetonitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. November 2007 (JavaScript erforderlich).
- ↑ Eintrag zu CAS-Nr. 75-05-8 im European chemical Substances Information System ESIS
- ↑ a b Datenblatt Acetonitril bei Merck, abgerufen am 22. Februar 2010..
- ↑ Jack Ponton (September 2001): Azeotrope Databank (Queriable database). The Edinburgh Collection of Open Software for Simulation and Education, Edinburgh University. Abgerufen am 20. Februar 2008.
- ↑ Henning Wallentowitz (Hrsg.), Konrad Reif (Hrsg.): Handbuch Kraftfahrzeugelektronik: Grundlagen- Komponenten- Systeme- Anwendungen. 2. Auflage, Vieweg+Teubner, 2010, ISBN 978-3-8348-0700-7, S. 270.
- ↑ Institut National de Recherche et de Sécurité (INRS), Fiche toxicologique nº 104 : Acétonitrile, Paris, 2004
- ↑ a b Philip Wexler, Encyclopedia of Toxicology, 2005, Vol. 1, Elsevier, pp. 28-30
- ↑ Spanish Ministry of Health, Acetonitrile. Risk Assessment Report, European Chemicals Bureau
- ↑ a b c International Programme on Chemical Safety, Environmental Health Criteria 154. Acetonitrile, World Health Organization, Geneva, 1993
- ↑ Greenberg, M., Toxicological Review of Acetonitrile, United States Environmental Protection Agency, Washington, D.C., 1999
Wikimedia Foundation.

