- Dicobaltoctacarbonyl
-
Strukturformel 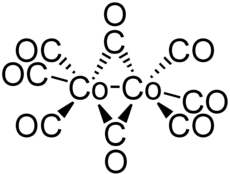
Allgemeines Name Dicobaltoctacarbonyl Summenformel Co2(CO)8 CAS-Nummer 10210-68-1 PubChem 25049 Kurzbeschreibung orangefarbene Kristalle[1]
Eigenschaften Molare Masse 341,95 g·mol−1 Aggregatzustand fest
Dichte 1,73 g·cm−3 (18 °C)[1]
Schmelzpunkt Dampfdruck Löslichkeit sehr schlecht in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 

Gefahr
H- und P-Sätze H: 250-317-351 EUH: keine EUH-Sätze P: 210-260-280-281-302+352 [2] EU-Gefahrstoffkennzeichnung [1] 

Leicht-
entzündlichGesundheits-
schädlich(F) (Xn) R- und S-Sätze R: 11-22-40-43-48/20-52/53-62 S: 36/37-61 LD50 754 mg·kg−1 (Ratte, oral)[2]
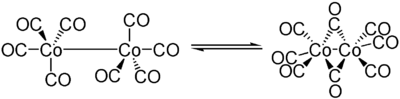
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Dicobaltoctacarbonyl ist ein zweikerniger Komplex, bei dem zwei Cobaltkerne von acht Carbonylliganden umgeben sind.
Inhaltsverzeichnis
Darstellung
Der Komplex kann durch die Reaktion von Cobalt(II)-Salzen unter hohem Kohlenstoffmonoxid-Drücken hergestellt werden. Oftmals wird diese Reaktion in Anwesenheit von Cyanidsalzen durchgeführt.
Eigenschaften
Dicobaltoctacarbonyl ist ein orangefarbener Feststoff, der sich bei 52 °C zersetzt. Auch bei Raumtemperatur zersetzt sich der Komplex an Luft langsam unter Freisetzung von Kohlenstoffmonoxid.[1]
Der Komplex liegt im Gleichgewicht zwischen zwei Strukturen, von denen eine aus zwei trigonal-bipyramidal-koordinierte Cobaltkerne mit einer Bindung zwischen den Cobaltatomen, die andere aus einen durch zwei Carbonylliganden verbrückten Komplex besteht. Das Gleichgewicht liegt hierbei auf der Seite der verbrückten Komplexspezies. Die Bindungslänge zwischen den Cobaltkernen im verbrückten Komplex beträgt 252 pm, die Co-C-Bindung zu den terminalen Carbonylen ist 180 pm, zu den verbrückenden Carbonylen 190 pm lang.[3]
Verwendung
Dicobaltoctacarbonyl wird in der Pauson-Khand-Reaktion zur Synthese von Cyclopentenonen benötigt. Hierbei liefert es durch Abspaltung von zwei Carbonyliganden die Cobaltspezies, die zur Addition an das eingesetzte Alkin dient. Gleiches gilt für die Nicholas-Reaktion, zu der dieselbe Cobaltspezies benötigt wird.
Durch Hydrierung des Komplexes bildet sich der einkernige Komplex HCo(CO)4.
Dieser Komplex wird als Katalysator für die Hydroformylierung eingesetzt. Dabei wird Dicobaltoctacarbonyl mit Wasserstoff umgesetzt, so dass Cobaltcarbonylhydrid als katalytisch wirkende Spezies entsteht.[4]
Die technische Synthese von Phenylbrenztraubensäure nutzt die Verbindung als Katalysator bei der doppelten Carbonylierung von Benzylchlorid mittels Kohlenmonoxid und Wasser.[5]Durch Reduktion mit elementaren Alkalimetallen können Co(CO)4−-Ionen gebildet werden.
Literatur
- Christoph Elschenbroich: Organometallchemie. 5. überarbeitete Auflage. Teubner, Wiesbaden 2005, ISBN 3-519-53501-7 (Teubner-Studienbücher Chemie).
- Lutz H. Gade: Koordinationschemie. Wiley-VCH, Weinheim u. a. 1998, ISBN 3-527-29503-8.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 10210-68-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. Juli 2008 (JavaScript erforderlich).
- ↑ a b c Datenblatt di-Cobaltoctacarbonyl bei Merck, abgerufen am 24. März 2011.
- ↑ G. G. Sumner, H. P. Klug, L. E. Alexander: The crystal structure of dicobalt octacarbonyl, in: Acta Cryst. 1964, 17, 732–742. doi:10.1107/S0365110X64001803
- ↑ Christoph Elschenbroich: Organometallchemie. 6. Auflage, Teubner Wiesbaden, 2008, ISBN 978-3-8351-0167-8, S. 633-637.
- ↑ Bertleff, W.; Roeper, M.; Sava, X.: Carbonylation in Ullmann's Encyclopedia of Industrial Chemistry, 2007 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim. doi:10.1002/14356007.a05 217.pub2
Kategorien:- Sensibilisierender Stoff
- Stoff mit Verdacht auf krebserzeugende Wirkung
- Feuergefährlicher Stoff
- Gesundheitsschädlicher Stoff
- Stoff mit Verdacht auf reproduktionstoxische Wirkung
- Cobaltverbindung
- Carbonylkomplex
Wikimedia Foundation.