- Dischwefeldecafluorid
-
Strukturformel 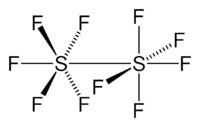
Allgemeines Name Dischwefeldecafluorid Andere Namen - Schwefelfluorid (mehrdeutig)
- Schwefelpentafluorid
- Schwefel(V)-fluorid
Summenformel F10S2 CAS-Nummer 5714-22-7 PubChem 62586 Kurzbeschreibung farblose Flüssigkeit mit Geruch nach Schwefeldioxid[1]
Eigenschaften Molare Masse 254,12 g·mol−1 Aggregatzustand flüssig
Dichte 2,08 g·cm−3[1]
Schmelzpunkt Siedepunkt 28,7 °C[1]
Dampfdruck Löslichkeit unlöslich in Wasser[2]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Dischwefeldecafluorid ist eine chemische Verbindung aus der Gruppe der anorganischen Schwefelverbindungen und Fluoride, welches 1934 durch Denbigh und Whytlaw-Gray entdeckt wurde.[4]
Inhaltsverzeichnis
Gewinnung und Darstellung
Dischwefeldecafluorid bildet sich als Nebenprodukt bei der Reaktion von Schwefel mit Fluor oder auf photochemischem Wege aus Schwefelchloridpentafluorid.[5]
Eigenschaften
Dischwefeldecafluorid ist eine farblose Flüssigkeit mit Geruch nach Schwefeldioxid und ist durch die Bildung von SF5•-Radikalen sehr reaktionsfreudig. Bei Erhitzung zersetzt sie sich in Schwefelhexafluorid und Schwefeltetrafluorid. Bei Vorhandensein eines Überschusses an Chlor reagiert sie zu Schwefelchloridpentafluorid.
Dischwefeldecafluorid ist unlöslich in Wasser und reagiert auch nicht mit diesem.[6] Es wird auch nicht durch wässrige Lösungen im sauren und alkalischen Bereich, jedoch in 10%iger Kaliumhydroxid-Lösung in Methanol hydrolysiert.[2]
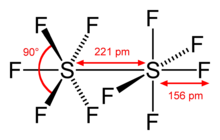
In der nebenstehenden Abbildung sind Bindungslängen und -winkel des Dischwefeldecafluorids dargestellt.
Sicherheitshinweise
Dischwefeldecafluorid ist sehr giftig. Es wirkt bei Inhalation schon im ppm-Bereich tödlich auf Ratten. Untersuchungen ergaben, dass es mindestens dreimal so giftig ist wie Phosgen.[7] Aus diesen Gründen war es im Zweiten Weltkrieg als Lungenkampfstoff angedacht, da es bei Kontakt mit den Augen keine Tränen oder keine Hautreizungen, wie viele andere chemische Kampfstoffe, auslöst und damit schwer rechtzeitig erkannt werden kann. [8]
Einzelnachweise
- ↑ a b c d e Eintrag zu CAS-Nr. 5714-22-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Juni 2010 (JavaScript erforderlich)
- ↑ a b Infrarot-spektrometrische Spurengasbestimmung in für elektrische Schaltanlagen verwendetem Schwefelhexafluorid
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Kenneth G. Denbigh and Robert Whytlaw-Gray: The preparation and properties of disulphur decafluoride. In: J. Chem. Soc. 1934, S. 1346–1352. doi:10.1039/JR9340001346.
- ↑ Hans P. Latscha,Helmut A. Klein; Anorganische Chemie, ISBN 978-3-540-42938-8.
- ↑ Holleman, Wiberg: Lehrbuch der anorganischen Chemie, S.565, ISBN 978-3-11-012641-9.
- ↑ Fritz Ullmann; Ullmanns Encyklopädie der technischen Chemie, ISBN 978-3-527-20000-9.
- ↑ Harold Johnston: A bridge not attacked: chemical warfare civilian research during World War II, S. 33–36, World Scientific 2003, ISBN 9812381538
Weblinks
Wikimedia Foundation.