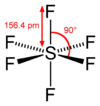- Anti-Helium
-
Strukturformel 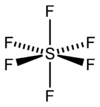
Allgemeines Name Schwefelhexafluorid Andere Namen Schwefel(VI)-fluorid
Summenformel SF6 CAS-Nummer 2551-62-4 Kurzbeschreibung farbloses Gas Eigenschaften Molare Masse 146,1 g·mol−1 Aggregatzustand gasförmig[1]
Dichte 6,18 kg·m−3 (15 °C)[1]
Schmelzpunkt Dampfdruck Löslichkeit sehr schlecht in Wasser (40 mg·l−1)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: 9-23 GWP 22.800 (bezogen auf 100 Jahre) [2] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Schwefelhexafluorid ist eine anorganische, chemische Verbindung aus den Elementen Schwefel und Fluor mit der Summenformel SF6. Es ist unter Normalbedingungen ein farb- und geruchloses, ungiftiges Gas, das unbrennbar ist und sich äußerst reaktionsträge, ähnlich wie Stickstoff, verhält.
Inhaltsverzeichnis
Gewinnung und Darstellung
Schwefelhexafluorid kann direkt aus den Elementen durch Umsetzung von elementarem Schwefel (S8) im Fluorgasstrom (F2) synthetisiert werden. Die Reaktion verläuft stark exotherm.

Neben SF6 bilden sich bei diesem Syntheseweg auch weitere Schwefelfluoride, wie zum Beispiel Dischwefeldecafluorid (S2F10). Daher wird bei der technischen Herstellung das Gas auf 400 °C erhitzt, wodurch eine Disproportionierung von Dischwefeldecafluorid in Schwefelhexafluorid und Schwefeltetrafluorid (SF4) erfolgt.
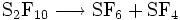
Durch Waschen des Gasgemisches in Lauge wird das Schwefeltetrafluorid zerstört, während SF6 durch die Lauge nicht angegriffen wird.
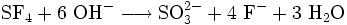
Durch anschließende Druckdestillation wird das reine SF6 abgetrennt.
Eigenschaften
Physikalische Eigenschaften
Schwefelhexafluorid ist unter Normalbedingungen gasförmig. Es hat eine etwa fünfmal höhere Dichte als Luft. Sein Schmelzpunkt liegt bei −50,8 °C, der Sublimationspunkt bei −63,8 °C. Die kritische Temperatur beträgt 45,55 °C, das kritische Volumen ist 197,4 ml/mol und der kritische Druck liegt bei 3,76 MPa.
Chemische Eigenschaften
Die sechs Fluoratome sind perfekt oktaedrisch um das zentrale Schwefelatom angeordnet; die Bindungslänge beträgt jeweils 156,1 pm. Aufgrund seiner Struktur ist es praktisch chemisch inert und verhält sich daher ähnlich wie elementarer Stickstoff oder die Edelgase. Es ist nahezu unlöslich in Wasser und nicht entflammbar.
Auf Grund seiner Inertheit sind Reaktionen in der Regel nur unter drastischeren als der Normalbedingung durchführbar. So setzt sich Natrium mit SF6 in flüssigem Ammoniak zu Natriumsulfid und Natriumfluorid um:
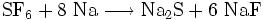 .
.In Gegenwart von Schwefelwasserstoff ist die Komproportionierung zu elementarem Schwefel und Fluorwasserstoff (HF) bekannt:
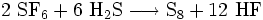 .
.SF6 ist isoelektronisch zu den Anionen Hexafluorophosphat (PF6−), Hexafluorosilicat (SiF62−) und Hexafluoroaluminat (AlF63−).
Verwendung
Wegen seiner hohen Dichte, der hohen Ionisierungsenergie und der Eigenschaft freie Elektronen zu binden, wird Schwefelhexafluorid (SF6) als Isoliergas in der Mittel- und Hochspannungstechnik eingesetzt, beispielsweise in Hochspannungsschaltern[3] in Schaltanlagen wie auch in komplett gekapselten Schaltanlagen von 6 kV bis 800 kV. Dort dient es auch als Löschgas, um den Schaltlichtbogen zu unterbrechen. Die Durchschlagsfestigkeit ist bei Atmosphärendruck fast dreimal höher als in Luft oder Stickstoff. Die geringen dielektrischen Verluste machen es als Isoliergas in Koaxialkabeln geeignet.
Weiterhin wird SF6 in Halbleiter-, Displaytechnik, Dichtheitsprüfung von Leckagen von 1·10−9 mbar·l/s und Mikrotechnik eingesetzt. Im Halbleiterbereich dient es als Ätzgas und wird als Isoliergas beim Routinetesten mikroelektronischer Schaltkreise im Rahmen der Qualitätssicherung verwendet. Außerdem wird es zum Reinigungsätzen eingesetzt. Dies ist auch das primäre Einsatzgebiet von SF6 im Display-Bereich. In der Mikrotechnik ist SF6 ein Schlüsselmedium im sehr verbreiteten DRIE-Prozess (DRIE-Prozess = Deep Reactive Ion Etching).
Weiterhin verwendet man SF6 in großem Umfang als Schutzgas bei der technischen Erzeugung von Magnesium. Das spezifisch schwere SF6 verhindert hier den Kontakt der heißen Metallschmelze mit der Luft. Prozessbedingt werden bei dieser Anwendung sehr große SF6-Mengen in die Atmosphäre abgegeben.SF6 wurde früher als Isoliergas zwischen Isolierglasscheiben benutzt sowie als Füllgas in Sohlen von Sportschuhen. Außerdem wurde Schwefelhexafluorid bis etwa zum Jahr 2000 auch zur Befüllung von Autoreifen eingesetzt, obwohl das, bedingt durch den hohen Preis des Schwefelhexafluorides, pro Reifensatz bis zu 100 DM (ca. 50 €) kostete (siehe auch Reifengas). Alle drei vorgenannten Anwendungen sind inzwischen aus Gründen des Umweltschutzes verboten.[4] [5]
Klimaschädlichkeit
SF6-Gas ist laut einer Studie des Intergovernmental Panel on Climate Change (Zwischenstaatlicher Ausschuss für Klimaänderungen) das stärkste bekannte Treibhausgas. 1 kg dieses Gases ist, auf einen Zeitraum von 100 Jahren betrachtet, genauso schädlich wie 22.800 kg Kohlendioxid (CO2).[2] Wegen der sehr geringen Konzentration von SF6 in der Erdatmosphäre (ca. 0,005 ppb volumenbezogen, was 0,12 ppmV CO2-Äquivalent entspricht.; CO2 ca. 365 ppm) wird sein Einfluss auf die globale Erwärmung jedoch als verhältnismäßig gering betrachtet. Es trägt nicht wesentlich zur Zerstörung der Ozonschicht bei. Der Abbau des SF6-Gases in der Atmosphäre durch energiereiche UV-Strahlung der Sonne dauert ca. 3.200 Jahre. Die Emission durch elektrotechnische Anlagen in Deutschland betrug 1997 10 % von 238 t der Gesamtemission.
Kurioses
Wegen seiner etwa fünfmal höheren Dichte im Vergleich zu normaler Luft kann Schwefelhexafluorid wie eine Flüssigkeit in Behälter gegossen werden. Auf dem SF6-Spiegel können dann extrem leichte Objekte etwa aus Alufolie „schwimmen“.
Zu einem interessanten Effekt kommt es, wenn SF6 eingeatmet wird. Im Gegensatz zu Helium erhält man wegen der gegenüber Luft wesentlich höheren Dichte von SF6 und der daraus resultierenden geringeren Schallgeschwindigkeit im Gas eine tiefe Stimmlage. Vor derartigen Experimenten wird ausdrücklich gewarnt, da Schwefelhexafluorid die Abatmung des Kohlenstoffdioxids behindert. Die Gefahr einer Kohlendioxidnarkose oder eines Atemstillstandes ist größer als bei der Verwendung anderer sauerstofffreier Gase wie Stickstoff oder Helium. Hintergrund ist die geringere Diffusionsgeschwindigkeit von Gasen in Schwefelhexafluorid, das auf Grund seines großen Stoßquerschnitts und seiner hohen molaren Masse die mittlere freie Weglänge herabsetzt. Außerdem sammelt sich das schwere Gas in der Lunge und kann u.U. nur durch einen Kopfstand aus der Lunge entfernt werden.
Literatur
- Arnold Fr. Holleman, Egon Wiberg: Lehrbuch der Anorganischen Chemie. 101 Auflage. Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 561ff.
Quellen
- ↑ a b c d e f Sicherheitsdatenblatt (praxair)
- ↑ a b P. Forster, P., V. Ramaswamy et al.: Changes in Atmospheric Constituents and in Radiative Forcing. In: Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge und New York 2007, S. 212, (PDF)
- ↑ Technik von Hochspannungsschaltern
- ↑ Chemikalien-Risikoreduktions-Verordnung, Anhang 1.5
- ↑ Verordnung (EG) Nr. 842/2006 über bestimmte fluorierte Treibhausgase, Art. 8f. sowie Anhang II
Weblinks
- SF6 in elektrischen Betriebsmitteln > 1000 Volt Informationsseiten zum Thema SF6 vom Zentralverband Elektrotechnik- und Elektronikindustrie e.V. (ZVEI)
- International Chemical Safety Cards: Schwefelhexafluorid (en)
- Video der beiden Effekte im Abschnitt Kurioses
Wikimedia Foundation.