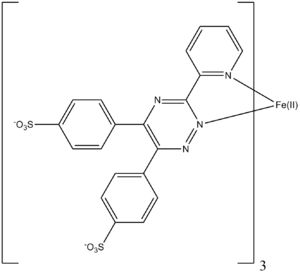
- Ferrozin
-
Strukturformel 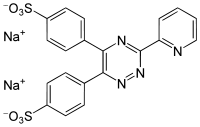
Natriumsalz von Ferrozin Allgemeines Name Ferrozin Andere Namen IUPAC: Dinatrium-4-[3-pyridin-2-yl-6-(4-sulfonatophenyl)-1,2,4-triazin-5-yl]benzosulfonat
Summenformel C20H12N4Na2O6S2 · x H2O CAS-Nummer 28048-33-1 PubChem 34127 Kurzbeschreibung gelbes, geruchloses Pulver[2]
Eigenschaften Molare Masse 492,46 g/mol Aggregatzustand fest[2]
Schmelzpunkt > 300 °C[3]
Löslichkeit löslich in Wasser [4]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [4] keine GHS-Piktogramme H- und P-Sätze H: keine H-Sätze EUH: keine EUH-Sätze P: keine P-Sätze EU-Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-37/39 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ferrozin ist eine organische chemische Verbindung aus der Gruppe der Arensulfonsäuresalze. Die wässrige Lösung dient als Reagens für die photometrische Bestimmung von Eisen.
Inhaltsverzeichnis
Eigenschaften
Ferrozin ist eine feste, gelbliche, geruchlose und wasserlösliche Verbindung.[4] Der Schmelzpunkt liegt über 300 °C.[3]
Anwendung in der Serum-Eisen-Bestimmung
Das im Blut enthaltene Eisen ist nicht frei, in Form von Ionen, sondern an Proteinen wie z.B. Hämoglobin oder dem Transferrin gebunden. Wenn Blut ohne geringungshemmenden Mitteln gesammelt wird verklumpt es. Dabei wird die übrigbleibende Flüssigkeit Serum genannt. Das Serum enthält normalerweise 1µg Fe je Milliliter, welches an Transferrin gebunden ist. Um die Serum-Eisen-Konzentration zu bestimmen, sind drei Arbeitsvorgänge notwendig für welche Komplexierung durch Ferrozin essentiell ist.
Schritt 1: Fe3+ im Transferrin wird zu Fe2+ reduziert und dabei aus dem Protein entfernt. Meist verwendete Reduktionsmittel sind Hydroxylaminhydrochlorid, Ascorbinsäure oder wie im folgenden Beispiel Thioglycolsäure:
Schritt 2: Trichloressigsäure wird für die Fällung aller Proteine zugesetzt, wobei Fe2+ in Lösung verbleibt. Die Proteine werden anschließend durch Zentrifugieren entfernt. Wenn Proteine in der Lösung bleiben, würden sie teilweise in der Lösung bei der Spektralphotometrie ausgefällt werden. Lichtstreuungen an den Teilchen des Niederschlags könnten dann zu Fehlern bei der Extinktionsmessung führen.
allgemein:
Schritt 3: Ein definiertes Volumen der überstehenden Flüssigkeit aus Schritt 2 wird in ein frisches Gefäß überführt und mit einem Überschuss an Ferrozin versetzt, um den purpurfarbenen Komplex zu bilden, dessen Extinktion gemessen wird (zwischen 550–600 nm maximale Absorption). Zusätzlich wird die Lösung gepuffert, um den pH auf den Bereich der vollständigen Komplexbildung des Ferrozin-Eisen-Komplexes zu bringen.
In der eben beschriebenen Serum-Eisen-Bestimmung liegen die ermittelten Werte etwa 10 % zu hoch, da auch das Kupfer als Spurenelement im Serum mit Ferozin reagieren kann. Diese Interferenz lässt sich durch Zusatz von Neocuproin oder Thioharnstoff eliminieren. Da diese Reagenzien sehr starke Komplexe mit Kupfer bilden können, erfolgt eine Maskierung.
Literatur
- Daniel C. Harris, Lehrbuch der Quantitativen Analyse 1995.
Einzelnachweise
- ↑ Erbslöh Greisenheim: Datenblatt Ferrozin.
- ↑ a b c Datenblatt Ferrozin bei Acros, abgerufen am 26. Februar 2010.
- ↑ a b Datenblatt Ferrozin bei ChemBlink, abgerufen am 26. Februar 2010.
- ↑ a b c Datenblatt Ferrospectral® bei Merck, abgerufen am 1. April 2011.
- ↑ Ferrozin bei ChemIDplus.
- ↑ Ecotoxicology and Environmental Safety. Vol. 6, Pg. 149, 1982.
Kategorien:- Reizender Stoff
- Nachweisreagenz
- Benzolsulfonsäure
- Triazin
Wikimedia Foundation.