- Lithiumacetat
-
Strukturformel 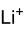
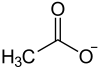
Allgemeines Name Lithiumacetat Andere Namen Lithiumethanoat (nach IUPAC)
Summenformel C2H3LiO2 CAS-Nummer - 546-89-4
- 6108-17-4 (Dihydrat)
PubChem 23666338 Kurzbeschreibung weißer, geruchloser Feststoff[1]
Eigenschaften Molare Masse Aggregatzustand fest
Dichte Schmelzpunkt Löslichkeit gut in Wasser (408 g·l−1[4] bzw. 290 g·l−1 (Dihydrat)[1], jeweils bei 20 °C)
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 
Achtung
H- und P-Sätze H: 302 EUH: keine EUH-Sätze P: 264-270-301+312-330-501 [3] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 36 S: 26-39 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Lithiumacetat ist das Lithiumsalz der Essigsäure mit der Summenformel CH3COOLi.
Inhaltsverzeichnis
Gewinnung und Darstellung
Lithiumacetat kann durch Salzbildungsreaktion aus Lithiumhydroxid und Essigsäure hergestellt werden.[5]
Ebenso ist die Synthese aus Lithiumcarbonat und Essigsäure unter Entwicklung von Kohlendioxid möglich.[5]
Eigenschaften
Lithiumacetat ist im Handel üblicherweise als weißes Dihydrat mit der Formel CH3COOLi · 2 H2O erhältlich.[6] Das Dihydrat kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Cmm2 mit den Gitterkonstanten a = 6,86 Å, b = 11,49 Å und c = 6,59 Å.[7] Das Anhydrat kristallisiert im triklinen Kristallsystem in der Raumgruppe
 mit den Gitterkonstanten a = 9,29 Å, b = 12,13 Å und c = 6,76 Å sowie α = 101°, β = 100° und γ = 105°.[2]
mit den Gitterkonstanten a = 9,29 Å, b = 12,13 Å und c = 6,76 Å sowie α = 101°, β = 100° und γ = 105°.[2]Verwendung
Lithiumacetat wird als Puffersubstanz bei der Gelelektrophorese von DNA und RNA, bei der Transformation von Hefezellen durch die Lithiumacetat-Methode[8] und in der Lithiumtherapie verwendet. Weiterhin dient es als Katalysator in der Polyesterproduktion, als Korrosionsschutzmittel in Polyphenylsulfidharzen und als Katalysator in der Produktion von Alkydharzen und Acrylpolymeren.[9]
Einzelnachweise
- ↑ a b c d Datenblatt Lithiumacetat bei Acros, abgerufen am 21. Mai 2010. (Dihydrat)
- ↑ a b C. Saunderson, R. B. Ferguson: Crystal data for anhydrous lithium acetate. In: Acta Cryst. (1961). 14, 321, doi:10.1107/S0365110X61001017.
- ↑ a b c Datenblatt Lithiumacetat bei AlfaAesar, abgerufen am 21. Mai 2010 (JavaScript erforderlich).
- ↑ a b Datenblatt Lithiumacetat bei Acros, abgerufen am 21. Mai 2010. (Reinsubstanz)
- ↑ a b Ulrich Wietelmann, Richard J. Bauer: Lithium and Lithium compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a15 393.
- ↑ Datenblatt Lithiumacetat bei Sigma-Aldrich, abgerufen am 20. Mai 2010.
- ↑ V. Amirthalingam, V. M. Padmanabhan: The crystal structure of lithium acetate dihydrate CH3COOLi.2H2O. In: Acta Cryst. 1958. 11, S. 896, doi:10.1107/S0365110X58002541.
- ↑ Hefe Grundlagen und Theorie (Uni-Graz)
- ↑ lithium acetate dihydrate (FMC Lithium)
Wikimedia Foundation.


