- Nickelacetat
-
Strukturformel 
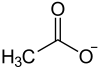
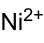
Allgemeines Name Nickelacetat Andere Namen Nickel(II)-acetat
Summenformel C4H6NiO4 CAS-Nummer - 373-02-4 (wasserfrei)
- 6018-89-9 (Tetrahydrat)
PubChem 9756 Kurzbeschreibung grünliche Kristalle mit schwachem charakteristischen Geruch[1]
Eigenschaften Molare Masse - 176,78 g·mol−1 (Reinsubstanz)
- 248,86 g·mol−1 (Tetrahydrat)
Aggregatzustand fest
Dichte 1,768 g·cm−3[1]
Schmelzpunkt Zersetzung [2]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 


Gefahr
H- und P-Sätze H: 350i-341-360D-372-332-302-334-317-410 EUH: keine EUH-Sätze P: 201-273-308+313-501 [1] EU-Gefahrstoffkennzeichnung [1] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 49-61-20/22-42/43-48/23-68-50/53 S: 53-45-60-61 LD50 350 mg·kg−1 (oral Ratte)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Nickelacetat ist das Nickelsalz der Essigsäure und gehört zur Gruppe der Acetate.
Inhaltsverzeichnis
Gewinnung und Darstellung
Nickelacetat kann durch Reaktion von Nickel(II)-carbonat mit Essigsäure hergestellt werden.[4]
Eigenschaften
Nickelacetat tritt üblicherweise als Tetrahydrat auf. Der Kristallwassergehalt wurde erstmals 1878 von H. Stallo bestimmt.[4] Nickelacetat-Tetrahydrat kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/c mit den Gitterparametern a = 476,4 pm, b = 1177,1 pm, c = 842,5 pm und β = 93,6°. In der Elementarzelle befinden sich zwei Formeleinheiten.[5][6]
Nickelacetat-Tetrahydrat beginnt bei ca 80 °C sein Kristallwasser abzugeben.[7][8] Beim weiteren Erhitzen entsteht ein wasserfreies basisches Nickelacetat mit der stöchiometrischen Zusammensetzung 0,86 Ni(CH3COO)2·0,14 Ni(OH)2.[9] Die Zersetzung beginnt bei 250 °C, als Zwischenprodukte entstehen Nickelcarbid[8][9] und Nickel(II)-carbonat.[10] Die Endprodukte der Zersetzung sind Nickel(II)-oxid und elementares Nickel.[7][10]
Verwendung
Nickelacetat wird zum Beizen von Textilien und für Beschichtungen beim Eloxieren eingesetzt.[2]
Sicherheit
Nickelacetat ist als krebserzeugend eingestuft.[1]
Einzelnachweise
- ↑ a b c d e f g Datenblatt Nickelacetat bei AlfaAesar, abgerufen am 25. Februar 2011 (JavaScript erforderlich).
- ↑ a b c Eintrag bei www.chemicalland21.com
- ↑ Eintrag zu CAS-Nr. 373-02-4 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ a b F. W. Clarke: „Einige Bestimmungen specifischer Gewichte“, in: Berichte der Deutschen chemischen Gesellschaft, 1878, 11 (2), S. 1504–1507; doi:10.1002/cber.18780110261; Volltext bei gallica.
- ↑ T. C. Downie, W. Harrison, E. S. Raper, M. A. Hepworth: „A Three-Dimensional Study of the Crystal Structure of Nickel Acetate Tetrahydrate“, in: Acta Crystallographica, 1971, B27, S. 706–712; doi:10.1107/S0567740871002802.
- ↑ J. N. Van Niekerk, F. R. L. Schoening: „The crystal structures of nickel acetate, Ni(CH3COO)2·4H2O, and cobalt acetate, Co(CH3COO)2·4H2O“, in: Acta Crystallographica, 1953, 6 (7), S. 609–612; doi:10.1107/S0365110X5300171X.
- ↑ a b M. A. Mohamed, S. A. Halawy, M. M. Ebrahim: „Non-isothermal decomposition of nickel acetate tetrahydrate“, in: Journal of Analytical and Applied Pyrolysis, 1993, 27 (2), S. 109–110. doi:10.1016/0165-2370(93)80002-H.
- ↑ a b M. A. A. Elmasry, A. Gaber, E. M. H. Khater: „Thermal decomposition of Ni(II) and Fe(III) acetates and their mixture“, in: Journal of Thermal Analysis and Calorimetry, 1996, 47, S. 757–763; doi:10.1007/BF01981811.
- ↑ a b J. C. De Jesus, I. Gonzalez, A. Quevedo, T. Puerta: „Thermal decomposition of nickel acetate tetrahydrate: an integrated study by TGA, QMS and XPS techniques“, in: Journal of Molecular Catalysis A: Chemical, 2005, 228 (1–2), S. 283–291; doi:10.1016/j.molcata.2004.09.065.
- ↑ a b G. A. M. Hussein, A. K. H. Nohman, K. M. A. Attyia: „Characterization of the decomposition course of nickel acetate tetrahydrate in air“, in: Journal of Thermal Analysis and Calorimetry, 1994, 42, S. 1155–1165; doi:10.1007/BF02546925.
Kategorien:- Krebserzeugender Stoff
- Stoff mit reproduktionstoxischer Wirkung
- Gesundheitsschädlicher Stoff
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff
- Giftiger Stoff
- Nickelverbindung
- Acetat
Wikimedia Foundation.

