- Thiophosphoryltrichlorid
-
Strukturformel 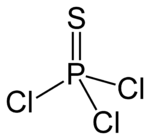
Allgemeines Name Thiophosphoryltrichlorid Andere Namen - Phosphorsulfochlorid
- Thiophosphorylchlorid
- Phosphorthiochlorid
Summenformel Cl3PS CAS-Nummer 3982-91-0 PubChem 19883 Kurzbeschreibung flüchtige, farblose Flüssigkeit mit stechendem Geruch[1]
Eigenschaften Molare Masse 169,40 g·mol-1 Aggregatzustand flüssig
Dichte 1,67 g·cm-3[1]
Schmelzpunkt Siedepunkt 125 °C[1]
Dampfdruck Löslichkeit - zersetzt sich in Wasser[1]
- löslich in vielen organischen Lösungsmitteln wie Benzol und Chloroform[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 

Gefahr
H- und P-Sätze H: 302-314-330 EUH: keine EUH-Sätze P: 260-280-284-305+351+338-310 [3] EU-Gefahrstoffkennzeichnung [1] 
Ätzend (C) R- und S-Sätze R: 34-37-52-53 S: 7/8-26 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Thiophosphoryltrichlorid ist eine anorganische chemische Verbindung aus der Gruppe der Phosphorhalide und Schwefelverbindungen.
Inhaltsverzeichnis
Gewinnung und Darstellung
Thiophosphoryltrichlorid kann durch verschiedene Reaktionen aus Phosphortrichlorid dargestellt werden. Die häufigste praktische Synthese, welche bei der industriellen Herstellung verwendet wird, ist die Reaktion von Phosphortrichlorid mit überschüssigem Schwefel bei 180 °C.[4]
Alternativ ist die Herstellung durch Reaktion von Phosphorpentasulfid und Phosphorpentachlorid mit einer Ausbeute von etwa 70% möglich.[5]
Eigenschaften
Thiophosphoryltrichlorid ist eine flüchtige, farblose Flüssigkeit mit stechendem Geruch. Sie ist chemisch instabil bei erhöhter Temperatur und hydrolysiert in Wasser langsam unter Bildung von Orthophosphorsäure, Salzsäure und Schwefelwasserstoff.
Verwendung
Thiophosphoryltrichlorid wird zur Herstellung von organischen Thiophosphorverbindungen (wie Insektiziden z.B. Parathion) und Thioamiden verwendet.[6]
Sicherheitshinweise
Thiophosphoryltrichlorid entzündet sich oder explodiert bei Erwärmung an Luft.[1]
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu CAS-Nr. 3982-91-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Juli 2011 (JavaScript erforderlich)
- ↑ Spilling, C. D. "Thiophosphoryl Chloride" in Encyclopedia of Reagents for Organic Synthesis John Wiley & Sons, Weinheim, 2001. doi: 10.1002/047084289X.rt104. Article Online Posting Date: April 15, 2001.
- ↑ a b Datenblatt Thiophosphoryl chloride bei Sigma-Aldrich, abgerufen am 24. April 2011.
- ↑ Betterman, G.; Krause, W.; Riess, G.; Hofmann, T. “Phosphorus Compounds, Inorganic” Ullman’s Encyclopedia of Industrial Chemistry. John Wiley & Sons: New York, 2005. doi: 10.1002/14356007.a19_527.
- ↑ Martin, D. R.; Duvall, W. M. “Phosphorus (V) Sulfochloride” Inorganic Syntheses, Volume IV. McGraw-Hill, 1953. doi: 10.1002/9780470132357.ch24.
- ↑ Fee, D. C.; Gard, D. R.; Yang, C. “Phosphorus Compounds” Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons: New York, 2005. doi: 10.1002/0471238961.16081519060505.a01.pub2.
Kategorien:- Gesundheitsschädlicher Stoff
- Ätzender Stoff
- Phosphorverbindung
- Schwefelverbindung
- Chlorverbindung
Wikimedia Foundation.




